题目内容
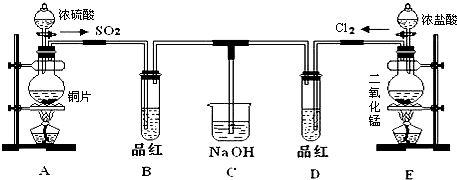
15.在生产生活中,我们会遇到各种各样的化学物质和化学反应,根据所学的化学知识回答问题:(1)漂白粉的有效成分为Ca(ClO)2(填化学式)
(2)硫酸氢钠的水溶液中的电离方程式:NaHSO4=Na++H++SO42-.
(3)石棉是一类建筑材料,化学式是Na2Fe5Si8O22(OH)2①化学式中铁元素的化合价为+2、+3;②这种石棉的化学式改写成氧化物形式为Na2O•Fe2O3•3FeO•8SiO2•H2O.
(4)酸性高猛酸钾具有强氧化性,常用作氧化剂.某反应中反应物和生成物有:MnO4-、NO2-、H+、Mn2+、H2O和一种未知的离子X,则X离子为NO3-.
分析 (1)氯气与石灰乳制备漂白粉;
(2)硫酸氢钠为强电解质,完全电离出钠离子、氢离子、硫酸根离子;
(3)①石棉的化学式改写成氧化物形式为Na2O•Fe2O3•3FeO•8SiO2•H2O,化合物中正负化合价的代数和为0;
②按照活泼金属氧化物、较不活泼金属氧化性、二氧化硅、水的顺序排序,遵循原子守恒;
(4)MnO4-→Mn2+为还原反应,Mn元素的化合价降低,则N元素的化合价升高.
解答 解:(1)氯气与石灰乳制备漂白粉,生成氯化钙、次氯酸钙和水,则漂白粉的有效成分为Ca(ClO)2,故答案为:Ca(ClO)2;
(2)硫酸氢钠为强电解质,完全电离出钠离子、氢离子、硫酸根离子,电离方程式为NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(3)①石棉的化学式改写成氧化物形式为Na2O•Fe2O3•3FeO•8SiO2•H2O,Fe元素的化合价为+2、+3,故答案为:+2、+3;
②按照活泼金属氧化物、较不活泼金属氧化性、二氧化硅、水的顺序排序,遵循原子守恒,石棉的化学式改写成氧化物形式为Na2O•Fe2O3•3FeO•8SiO2•H2O,
故答案为:Na2O•Fe2O3•3FeO•8SiO2•H2O;
(4)MnO4-→Mn2+为还原反应,Mn元素的化合价降低,则N元素的化合价升高,可知NO2-→NO3-为氧化反应,所以X为NO3-,故答案为:NO3-.
点评 本题考查较综合,涉及氯气的性质、氧化还原反应及硅酸盐等,综合性较强,注重基础知识的考查及迁移应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.化学与生活密切相关,下列说法不正确的是( )
| A. | 甘油可作护肤保湿剂 | |
| B. | 无水氯化钙可用作食品干燥剂 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
20.芳香化合物C8H8O2属于酯和羧酸的同分异构体的数目分别是( )
| A. | 4和5 | B. | 5和4 | C. | 4和6 | D. | 6 和4 |
7.分类方法在化学学科的发展中起到重要的作用,下列完全正确的是( )
| A | B | C | D | |
| 强电解质 | AgCl | SO3 | 醋酸 | 熔融NaOH |
| 弱电解质 | 晶体桂 | BaSO4 | HF | Fe(OH)3 |
| 非电解质 | CH4 | 液氨 | C2H5OH | C02 |
| A. | A | B. | B | C. | C | D. | D |
4.下列关于食品添加剂的说法,不正确的是( )
| A. | 醋可同时用作防腐剂和调味剂 | |
| B. | 食品添加剂必须用天然物质制造 | |
| C. | 柠檬黄常用作着色剂,改善食品色泽 | |
| D. | 食品添加剂在合理限量范围内使用是可以的 |
5.下列各组离子中,在给定条件下能大量共存的是( )
| A. | 通入足量的二氧化碳后的溶液中Na+、$Al{O_2}^-、$$CH_3^{\;}CO{O^-}、$$C{O_3}^{2-}$ | |
| B. | 无色溶液中$M{g^{2+}}、Mn{O_4}^-、S{O_4}^{2-}、{I^-}$ | |
| C. | 酸性溶液中可能大量存在 $N{a^+}、Cl{O^-}、S{O_4}^{2-}、{I^-}$ | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中$N{H_4}^+、C{l^-}$、Al3+、$N{O_3}^-$ |
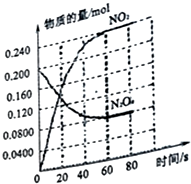 在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:
在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题: