题目内容
20.如图是元素周期表的一部分,其中每个数字编号代表对应的一种元素.请按要求回答下列问题:
(1)画出元素②的原子结构示意图
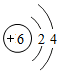 .
.(2)③和⑧的元素符号是N和Cl.
(3)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是Na2O、Na2O2.
(4)写出元素⑥的氢氧化物与氢氧化钠反应的化学方程式:NaOH+Al(OH)3=NaAlO2+2H2O.
分析 由元素在周期表的位置,①~⑨分别为H、C、N、O、Na、Al、Si、Cl、Ar,
(1)元素②的质子数为6,有2个电子层,最外层电子数为4;
(2)③、⑧分别为N、Cl;
(3)钠与O形成氧化钠或过氧化钠;
(4)⑥的氢氧化物与氢氧化钠反应,生成偏铝酸钠和水.
解答 解:由元素在周期表的位置,①~⑨分别为H、C、N、O、Na、Al、Si、Cl、Ar,
(1)元素②的质子数为6,有2个电子层,最外层电子数为4,则C的原子结构示意图为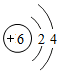 ,故答案为:
,故答案为: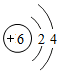 ;
;
(2)③、⑧分别为N、Cl,故答案为:N;Cl;
(3)钠与O形成氧化钠或过氧化钠,化学式分别为Na2O、Na2O2,故答案为:Na2O、Na2O2;
(4)⑥的氢氧化物与氢氧化钠反应,生成偏铝酸钠和水,发生反应为NaOH+Al(OH)3=NaAlO2+2H2O,故答案为:NaOH+Al(OH)3=NaAlO2+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.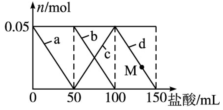 向100mL含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向100mL含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
 向100mL含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向100mL含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ | |
| B. | b曲线表示碳酸钠和盐酸反应,d曲线表示氢氧化铝的溶解 | |
| C. | M点时,溶液中沉淀的质量小于3.9 g | |
| D. | 原混合溶液中的Na2CO3溶液的浓度为1 mol•L-1 |
15.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+.取该溶液100mL,加入过量NaOH溶液并加热,得到0.02mol气体,同时产生红褐色沉淀;将过滤洗涤后的沉淀灼烧得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.下列说法正确的是( )
| A. | 该溶液中最多存在4种离子 | |
| B. | 该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 | |
| C. | 该溶液中一定存在Cl-、且c(Cl-)≥0.4mol•L-1 | |
| D. | 该溶液中不能确定是否存在CO32- |
5.进入秋冬季节后,雾霾这种环境污染问题逐渐凸显.从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是( )
| A. | 胶粒可以导电 | B. | 胶体有丁达尔效应 | ||
| C. | 胶体粒子大小在1~100nm之间 | D. | 胶体的分散剂为气体 |
12.下列气体的制备和性质实验中,由现象得出的结论错误的是( )
| 选项 | 试剂 | 试纸/试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | 紫色石蕊试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉碘化钾试纸 | 变蓝 | Cl2具有氧化性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
10.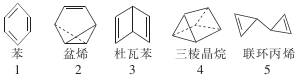 在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
 在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )| A. | 1~5对应的结构均能与氢气在一定条件下发生加成反应 | |
| B. | 1~5对应的结构中的一氯取代物只有1种的有3个 | |
| C. | 1~5对应的结构中所有原子均可能处于同一平面的有1个 | |
| D. | 1~5对应的结构中能使溴的四氯化碳溶液褪色的有4个 |
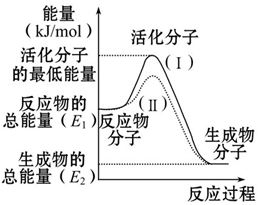 请认真观察如图,然后回答问题:
请认真观察如图,然后回答问题: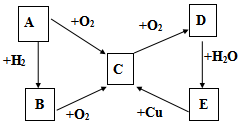 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.