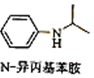
题目内容
12.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如图:
已知:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.1 | 9.4 |
(2)加入H2O2氧化时,反应体系中的反应物和生成物有:FeSO4、H2O2、H2SO4、Fe2(SO4)3、H2O,该反应中的还原剂是FeSO4(填化学式,下同)、还原产物是H2O.
(3)滤渣2的成分是Fe(OH)3(填化学式).
(4)煅烧过程存在以下反应:
①2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
②MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
③MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
反应①中若生成40gMgO,转移电子物质的量为2mol.
分析 制备高纯氧化镁的实验流程:菱镁矿(主要成分为MgCO3,含少量FeCO3)加入酸溶解,过滤得到溶液中含有亚铁离子和镁离子,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入一水合氨调节溶液PH为4,使铁离子全部沉淀,过滤得到滤渣2为氢氧化铁沉淀,滤液为硫酸镁溶液,蒸发浓缩,冷却结晶,过滤洗涤制备硫酸镁,硫酸镁与木炭煅烧得到MgO,以此解答该题.
解答 解:(1)碳酸镁可以和硫酸之间反应生成硫酸镁、水以及二氧化碳,即MgCO3+2H+═Mg2++CO2↑+H2O,
故答案为:MgCO3+2H+=Mg2++H2O+CO2↑;
(2)加入H2O2 氧化时,在酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O,反应中Fe因素化合价升高,还原剂为FeSO4,O元素化合价降低,H2O为还原产物,
故答案为:FeSO4; H2O;
(3)由以上分析可知滤渣2的成分是Fe(OH)3,故答案为:Fe(OH)3;
(4)反应①中若生成40gMgO,n(MgO)=$\frac{40g}{40g/mol}$=1mol,由方程式可知同时生成0.5molCO2,转移电子的物质的量为0.5mol×(4-0)=2mol,
故答案为:2.
点评 本题考查物质的制备,为高频考点,侧重考查学生的分析能力、实验能力和计算能力,注意把握实验的原理、物质的性质,难度不大.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
15.下列说法不正确的是( )
| A. | 铁粉表面的油污用热的纯碱溶液去油污效果更好 | |
| B. | 常温下,向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法 | |
| D. | 室温下,向0.1mol•L-1的HF溶液中加入水溶液显碱性的物质,HF的电离程度一定增大 |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 100g质量分数为98%的浓硫酸中所含有的氧原子数为4NA | |
| C. | NA个H2分子与NA个D2O分子的质量比为1:9 | |
| D. | 标准状况下,5.6g乙烯和丙烯的混合气体中含C-H键的数目为0.8NA |

 .
. .
. .
. 、
、 .
.
 ),请根据下列转化关系图回答问题:
),请根据下列转化关系图回答问题:
 ,C的化学名称是乙二醛.
,C的化学名称是乙二醛.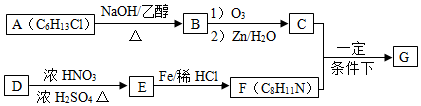
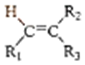 $→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+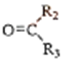
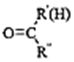 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$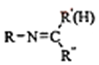 +H2O
+H2O .
. (写出其中一种的结构简式).
(写出其中一种的结构简式). $\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$
$\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$