题目内容
某非金属X的最低负价为-m.它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的分子式为( )
| A、H2b-8+mXOb |
| B、H2b-m+8XOb |
| C、H2b-8-mXOb |
| D、H2b+8+mXOb |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:根据化合物中正负化合价代数和为零进行计算.
解答:
解:该元素的最低价为-m,则该元素最高价为8-m;
含氧酸中含有b个O原子,设含氧酸中含有a个H原子,
氢元素显+1价,氧元素显-2价,根据在化合物中正负化合价代数和为零,可得:a×(+1)+(8-m)+b×(-2)=0,则a=2b+m-8,
故这种酸的分子式为H2b+m-8XOb,
故选A.
含氧酸中含有b个O原子,设含氧酸中含有a个H原子,
氢元素显+1价,氧元素显-2价,根据在化合物中正负化合价代数和为零,可得:a×(+1)+(8-m)+b×(-2)=0,则a=2b+m-8,
故这种酸的分子式为H2b+m-8XOb,
故选A.
点评:本题考查化合物分子式的有关计算,难度不大,关键要把握化合物中正负化合价代数和为零这一规律.

练习册系列答案
相关题目
有机物R结构如图所示,下列说法正确的是( )
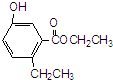

| A、R在碱性条件下的水解产物难溶于水 |
| B、R分子中有7种化学环境均不同的氢原子 |
| C、R和溴水反应后所得产物的化学式为C11H12O3Br2 |
| D、R不能使酸性高锰酸钾溶液褪色 |
有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2mol/L,c(Al3+)为0.3mol/L.使Mg2+全部转化为沉淀分离出来,至少需加4mol/L NaOH溶液的体积为( )
| A、40 mL |
| B、72 mL |
| C、80 mL |
| D、128 mL |
下列叙述正确的是( )
| A、SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理不同 |
| B、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
| C、增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| D、用AgNO3溶液可以鉴别KCl和KI |
菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷.下列说法中正确的是( )
| A、在该反应中维生素C作催化剂 |
| B、砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷可能是+3价砷 |
| C、因为河虾中含有砷元素,所以不能食用 |
| D、上述反应中维生素C作氧化剂 |
在1LNa2SO4的Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,加入1L0.3mol/L的BaCl2溶液恰好使SO42-完全沉淀,则混合容易中Na+的浓度为( )
| A、0.3mol/L |
| B、0.45mol/L |
| C、0.6mol/L |
| D、0.15mol/L |
甲、乙两烧杯中各盛有100mL 3mol/L盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得甲、乙两烧杯中产生的气体体积之比为3:4,则加入铝粉的质量为( )
| A、5.4g | B、3.6g |
| C、2.7g | D、1.6g |
下列化学用语中,书写错误的是( )
A、硫离子的结构示意图: |
| B、次氯酸的结构式:H-O-Cl |
C、CO2的比例模型: |
D、丙烷的球棍模型: |
下列关于Al(OH)3的性质叙述中错误的是( )
| A、Al(OH)3与过量的浓氨水反应生成NH4AlO2 |
| B、Al(OH)3是难溶于水的白色胶状物质 |
| C、Al(OH)3胶体能凝聚水中的悬浮物 |
| D、Al(OH)3受热能分解 |