题目内容
5.25℃时,1mol/L醋酸加水稀释至0.01mol/L,关于稀释前后的下列变化正确的是( )| A. | 溶液中c(OH-)减小 | B. | pH的变化值等于2 | ||
| C. | 溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | D. | Kw的值减小 |
分析 A、对醋酸加水稀释,溶液中的氢离子浓度减小;
B、加水稀释,醋酸的电离被促进;
C、加水稀释,溶液中的c(CH3COO-)减小,但醋酸的Ka不变;
D、Kw只受温度的影响.
解答 解:A、对醋酸加水稀释,溶液中的氢离子浓度减小,而Kw不变,故c(OH-)增大,故A错误;
B、加水稀释,醋酸的电离被促进,电离出的氢离子的物质的量增多,故pH的变化小于2,故B错误;
C、加水稀释,溶液中的c(CH3COO-)减小,但醋酸的Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变,故溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大,故C正确;
D、Kw只受温度的影响,温度不变,Kw的值不变,故加水稀释对Kw的值无影响,故D错误.
故选C.
点评 本题综合考查醋酸的电离,注意加水稀释醋酸,能促进醋酸电离,但溶液中醋酸根离子增大的量远远小于水体积增大的量,所以醋酸根离子浓度减小,为易错点.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
15.下列实验不能达到实验目的是( )
| A. |  萃取时振荡分液漏斗 | B. |  电解精炼铜 | ||
| C. |  铝热反应 | D. |  实验室模拟合成氨 |
17.下列金属在冷、浓的硝酸或硫酸中,能形成致密氧化膜的是( )
| A. | Mg | B. | Fe | C. | Cu | D. | Na |
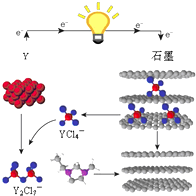
14.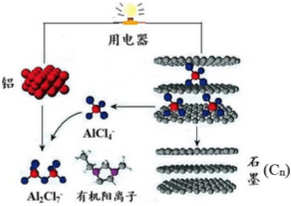 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 放电时,有机阳离子向铝电极方向移动 | |
| C. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- | |
| D. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 |
 实验小组为探究SO2的漂白性和还原性,设计了以下实验.
实验小组为探究SO2的漂白性和还原性,设计了以下实验.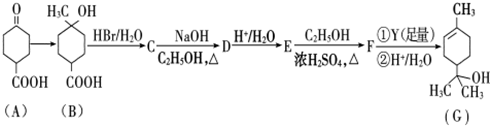
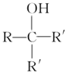
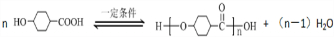 .
.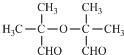 .
. X、Y、Z是同周期的短周期元素,原子序数依次增大.Y为地壳中含量最高金属元素,且X、Y、Z的最高价氧化物对应水化物两两之间可以相互反应.
X、Y、Z是同周期的短周期元素,原子序数依次增大.Y为地壳中含量最高金属元素,且X、Y、Z的最高价氧化物对应水化物两两之间可以相互反应.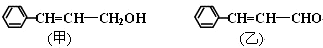
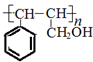 .
.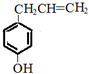 .
.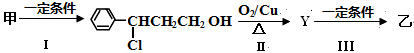
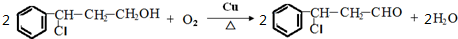 .
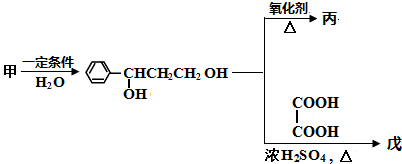
.
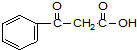 .
.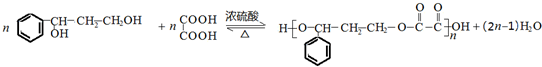 ;若戊为环状化合物,其结构简式是
;若戊为环状化合物,其结构简式是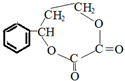 .
.