题目内容
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:
试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有 .(填字母序号)
A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子
C.[Cu(NH3)4]SO4的组成元素中配体是NH3,N原子提供空轨道
D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体
(2)NH4CuSO3中的金属阳离子的简化核外电子排布式为 .
(3)向硫酸铜的溶液中逐滴滴入氨水溶液至过量可得到[Cu(NH3)4]SO4溶液,出现的现象是 ,用反应的离子方程式为: ; .

试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有
A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子
C.[Cu(NH3)4]SO4的组成元素中配体是NH3,N原子提供空轨道
D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体
(2)NH4CuSO3中的金属阳离子的简化核外电子排布式为
(3)向硫酸铜的溶液中逐滴滴入氨水溶液至过量可得到[Cu(NH3)4]SO4溶液,出现的现象是
考点:铜金属及其重要化合物的主要性质,配合物的成键情况
专题:化学键与晶体结构,元素及其化合物
分析:(1)A.阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;
B.NH3为配体分子,溶液中不存在NH3;
C.根据配合物的组成及其概念来判断;
D.根据价层电子对互斥理论判断离子构型.
(2)NH4CuSO3中Cu的化合价为+1价,基态Cu+核外有28个电子,根据构造原理书写其核外电子排布式;
(3)先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液.
B.NH3为配体分子,溶液中不存在NH3;
C.根据配合物的组成及其概念来判断;
D.根据价层电子对互斥理论判断离子构型.
(2)NH4CuSO3中Cu的化合价为+1价,基态Cu+核外有28个电子,根据构造原理书写其核外电子排布式;
(3)先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液.
解答:
解:(1)A.[Cu(NH3)4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键,故A正确;
B.NH3为配体分子,溶液中不存在NH3,故B错误;
C.根据配合物的组成可以判断配体是NH3,但N原子是提高孤对电子,中心原子是提供空轨道,故C错误;
D.SO42-离子中价层电子对数为4+
×(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型,故D正确.
故答案为:AD;
(2)Cu原子的核外电子排布式为[Ar]3d104s1,NH4CuSO3中Cu的化合价为+1价,基态Cu+核外有28个电子,根据构造原理金属阳离子的核外电子排布式为[Ar]3d10,
故答案为:[Ar]3d10;
(3)先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液,发生Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:形成蓝色沉淀,继续滴加氨水蓝色沉淀溶解,得到深蓝色溶液;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O.
B.NH3为配体分子,溶液中不存在NH3,故B错误;
C.根据配合物的组成可以判断配体是NH3,但N原子是提高孤对电子,中心原子是提供空轨道,故C错误;
D.SO42-离子中价层电子对数为4+
| 1 |
| 2 |
故答案为:AD;
(2)Cu原子的核外电子排布式为[Ar]3d104s1,NH4CuSO3中Cu的化合价为+1价,基态Cu+核外有28个电子,根据构造原理金属阳离子的核外电子排布式为[Ar]3d10,
故答案为:[Ar]3d10;
(3)先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液,发生Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:形成蓝色沉淀,继续滴加氨水蓝色沉淀溶解,得到深蓝色溶液;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O.
点评:本题较为综合,突出考查配合物知识、核外电子排布、杂化类型、化学键、物质性质、配合物成键状况的了解,综合性较强,全面考查物质的结构和性质,题目难度较大.

练习册系列答案
相关题目
在密闭容器中进行如下反应:X2(g)+Y2(g)═2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol/L、0.4mol/L、0.3mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、X2为0.3mol/L |
| B、Y为0.65mol/L |
| C、Y2为0.2mol/L |
| D、Z为0.7mol/L |
FeCl3+Cu=2FeCl2+CuCl2.该反应利用了铜的什么性质( )
| A、氧化性 | B、还原性 |
| C、导电性 | D、导热性 |
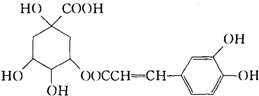 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )| A、2 molNaOH |
| B、4 molNaOH |
| C、6 molNaOH |
| D、8 molNaOH |
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在PH=5时已完全沉淀,其分析错误的是( )


| A、利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果 |
| B、若要用实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳 |
| C、洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次 |
| D、用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 |
下列各组物质能在同一溶液中大量共存的是( )
| A、CuSO4、H2SO4、HNO3 |
| B、Na2SO4、Ba(OH)2、CuCl2 |
| C、FeCl3、NaOH、KNO3 |
| D、K2SO4、NaOH、NaCl |
 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )| A、Mg2+、Al3+、Ba2+ |
| B、H+、Mg2+、Al3+ |
| C、H+、Cu2+、Al3+ |
| D、只有Mg2+、Al3+ |