题目内容
17.下列说法正确的是( )| A. | 按系统命名法,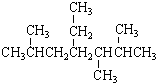 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4-二甲基戊烷 | |
| C. | 完全燃烧等质量的甲醛、乙酸、葡萄糖、蔗糖消耗的氧气量相等 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g |
分析 A.未满足取代基位次之和最小,主链编号错误;
B.根据2,4-二甲基戊烷为CH3CH(CH3)CH2CH(CH3)CH3,含有4种不同的H分析;
C.甲醛、乙酸、葡萄糖、蔗糖的最简式不同,等质量时耗氧量不同;
D.乙烯的分子式为C2H4,甲醛的分子式为CH2O,两物质中C、H原子数目之比都是1:2,故混合物中C、H元素质量之比=12:2=6:1,根据氧元素质量分数计算C、H元素质量分数之和,进而计算氢元素质量分数.
解答 解:A.主链含有7个碳为庚烷,从右端编号,化合物的名称应是2,3,5-三甲基-4-乙基庚烷,故A错误;
B.2,4-二甲基戊烷为CH3CH(CH3)CH2CH(CH3)CH3,含有4种不同的H,故B错误;
C.甲醛、乙酸、葡萄糖的最简式都为CH2O,与蔗糖的最简式不同,等质量时耗氧量不同,故C错误;
D.乙烯的分子式为C2H4,甲醛的分子式为CH2O,两物质中C、H原子数目之比都是1:2,故混合物中C、H元素质量之比=12:2=6:1,含氧的质量分数为a,则C、H元素质量分数之和=1-a,故H元素质量分数=(1-a)×$\frac{1}{1+6}$$\frac{1-a}{7}$,生成水的质量为14g×$\frac{1-a}{7}$×$\frac{1}{2}$×18=18(1-a)g,故D正确;
故选D.
点评 本题考查同分异构体、有机物燃烧的计算以等知识,题目难度不大,把握常见有机物的组成、官能团与性质的关系等为解答的关键.

练习册系列答案
相关题目
19.实验室电解饱和食盐水( )
| A. | 阳极发生还原反应 | B. | 铁丝接电源的负极 | ||
| C. | 电子由阴极经溶液流向阳极 | D. | 氯气在阴极区产生 |
8.下列叙述正确的是( )
| A. | 氧化性:F2<Cl2<Br2<I2 | |
| B. | 次氯酸能杀死病菌,所以氯气可用于自来水的消毒 | |
| C. | 漂白粉中含有次氯酸,所以漂白粉能使染料等有机色素褪色 | |
| D. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 |
5.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域.已知只有质子数或中子数为奇数的原子核才有NMR现象.试判断下列哪组原子均可产生NMR现象( )
| A. | 18O、31P、119Sn | B. | 27Al、19F、12C | ||
| C. | 7N、15P、33As、51Sb、83Bi | D. | 只有一个电子层的原子 |
2.下列说法正确的是( )
| A. | 按系统命名法 的名称为:4,7-二甲基-3-乙基壬烷 的名称为:4,7-二甲基-3-乙基壬烷 | |
| B. | 等物质的量的Na、NaOH、NaHCO3分别与足量的有机物( )充分反应,消耗该有机物的物质的量之比为2:3:6(已知酸性大小关系 )充分反应,消耗该有机物的物质的量之比为2:3:6(已知酸性大小关系 >H2CO3> >H2CO3> ) ) | |
| C. | 乙醇和二甲醚互为同分异构体,CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| D. | 蛋白质、油脂、糖均能在一定条件下水解 |
9.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| A. | ②③④ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |
6.浓硫酸滴在滤纸上,滤纸变黑,表明浓硫酸具有( )
| A. | 脱水性 | B. | 吸水性 | C. | 酸性 | D. | 不挥发性 |
7.标准状况下,11.2升二氧化碳气体的质量是( )
| A. | 11克 | B. | 22克 | C. | 44克 | D. | 5.6克 |
 ,G的结构简式
,G的结构简式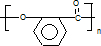 .
. .
. .
.