题目内容
10.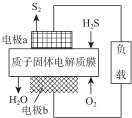 H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g )═S2(s)+2H2O(l)△H=-632kJ•mol-1.图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g )═S2(s)+2H2O(l)△H=-632kJ•mol-1.图为质子膜H2S燃料电池的示意图.下列说法正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极 b 上发生的电极反应为:O2+4H++4e-═2H2O | |
| C. | 该装置是一种将热能转化为电能的装置 | |
| D. | H+经质子膜进入a极区 |
分析 根据2H2S(g)+O2(g)═S2(s)+2H2O反应,得出负极H2S失电子发生氧化反应,正极O2得电子发生还原反应,据此分析解答.
解答 解:A.由2H2S(g)+O2(g)═S2(s)+2H2O反应,得出负极H2S失电子发生氧化反应,则a为电池的负极,故A错误;
B.正极O2得电子发生还原反应,所以电极b上发生的电极反应为:O2+4H++4e-=2H2O,故B正确;
C.该电池为原电池,该装置将化学能转化为电能,电池内部几乎不放出能量,故C错误;
D.原电池中阳离子向正极移动,则 H+经质子膜进入b极区,故D错误;
故选:B.
点评 本题侧重考查原电池原理,明确电解质溶液酸碱性是解本题关键,难点是电极反应式的书写,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 邻二溴苯只有一种可以证明苯环结构中不存在单双键交替结构 | |
| B. | 可以用分液漏斗分离苯和硝基苯 | |
| C. | 制取一氯乙烷的最佳途径是通过乙烷与氯气反应获得 | |
| D. | 等物质的量的乙醇和水分别与足量的钠反应,生成的气体体积比为3:1 |
2.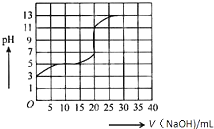 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )| A. | 该弱酸在滴定前的浓度大于0.001mol/L | |
| B. | 由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5 | |
| C. | 滴定过程为求滴定终点,最合适的指示剂是酚酞 | |
| D. | 滴定终点时,c(Na+)>c(A-)>c(OH-)>c(H+) |
19.反应3H2+N2$?_{催化剂}^{高温,高压}$2NH3在密闭容器中进行.下列关于该反应的说法错误的是( )
| A. | 升高温度能加快反应速率 | |
| B. | 使用恰当的催化剂能加快反应速率 | |
| C. | 增大N2的浓度能加快反应速率 | |
| D. | 平衡时各组分含量之比一定等于3:1:2 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24 L CO2与一定量的Na2O2反应转移的电子数目一定为0.1NA | |
| B. | C2H2、H2O2、Na2O2的最简式都可以用AB的形式表示 | |
| C. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 2.0 gH218O与D216O的混合物中所含中子数为NA |

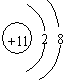 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键.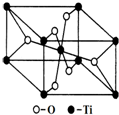 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4: