题目内容
关于强、弱电解质的有关叙述错误的是( )
| A.强电解质在水溶液中完全电离成阴、阳离子 |
| B.在溶液中,导电能力强的电解质是强电解质 |
| C.对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
B
解析

练习册系列答案
相关题目
下列说法正确的是
| A.向50 mL 1 mol·L-1的盐酸中加入烧碱,水的KW不变 |
| B.NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用 |
| C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) |
D.常温下0.1 mol·L-1的HA溶液中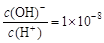 , 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1 , 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1 |
将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
| A.溶液的pH增大 | B.CH3COOH电离的百分率变大 |
| C.溶液的导电能力减弱 | D.溶液中c(OH-)减小 |
人体血液里存在如下平衡:CO2+H2O H2CO3
H2CO3
 使人体内血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。其pH随c(
使人体内血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。其pH随c( ):c(H2CO3)变化关系如表所示,则下列说法中,正确的是
):c(H2CO3)变化关系如表所示,则下列说法中,正确的是
c( ):c(H2CO3) ):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.正常人体血液中,
 的水解程度小于电离程度
的水解程度小于电离程度B.人体发生酸中毒时,可饮用碳酸饮料缓解
C.pH=7.00的血液中,c(H2CO3)=c(
 )
)D.常温下将pH=7.40的血液稀释至pH=7.35,c(H+)·c(OH-)一定不变
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: HZ<HY< HX |
| B.在HZ中加入NaOH至恰好完全反应时,溶液中各离子浓度大小顺序: c(Na+)>c(Z-)>c(OH—)>c(H+) |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)+c(Y—)+c(OH—)= c(Na+)+c(H+) |
| D.将HX和HZ溶液混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)= c(X—)+ c(Z—) |
氨水中存在下列的电离平衡:NH3·H2O NH
NH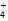 +OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
+OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
| A.NaOH固体 | B.NH4Cl固体 |
| C.H2SO4 | D.H2O |
在BaSO4饱和溶液中加入少量BaCl2溶液时产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)=c(SO )=(Ksp) )=(Ksp) |
B.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO )=Ksp,c(Ba2+)>c(SO ) ) |
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO )>Ksp,c(Ba2+)=c(SO ) ) |
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO )≠Ksp,c(Ba2+)<c(SO ) ) |
下列各组数据中,其比值为2∶1的是( )
A.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH ]∶[SO ]∶[SO ] ] |
| B.相同温度下,0.2 mol·L-1乙酸溶液与0.1 mol·L-1乙酸溶液中,[H+]之比 |
C.Na2CO3溶液中,[Na+]∶[CO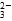 ] ] |
| D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]∶c(KOH) |
将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是( )
| A.KCl | B.Mg(OH)2 | C.Na2CO3 | D.MgSO4 |