题目内容
下列各组数据中,其比值为2∶1的是( )
A.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH ]∶[SO ]∶[SO ] ] |
| B.相同温度下,0.2 mol·L-1乙酸溶液与0.1 mol·L-1乙酸溶液中,[H+]之比 |
C.Na2CO3溶液中,[Na+]∶[CO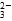 ] ] |
| D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]∶c(KOH) |
A
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
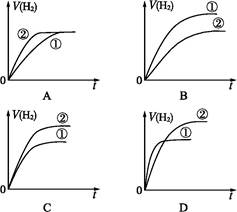
下列图示与对应的叙述相符的是
| A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系 |
| C.如上图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为 c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+) |
| D.用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂: HIn(aq)(红色)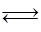 H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
| A.①④⑤ | B.②⑤⑥ | C.①④ | D.②③⑥ |
向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
| A.AgCl=AgI=Ag2S | B.AgCl<AgI< Ag2S |
| C.AgCl>AgI> Ag2S | D.AgI>AgCI> Ag2S |
下列物质的量浓度关系错误的是
| A.等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
D.0.1 mol·L-1的NaHCO3溶液:c(Na+)>c(OH-)>c( )>c(H+) )>c(H+) |
关于强、弱电解质的有关叙述错误的是( )
| A.强电解质在水溶液中完全电离成阴、阳离子 |
| B.在溶液中,导电能力强的电解质是强电解质 |
| C.对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2 mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是( )
| A.③>①>④>② | B.③>①>②>④ |
| C.①>④>③>② | D.①>③>④>② |
在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
| A.[Na+]=[CH3COO-]+[CH3COOH] |
| B.[H+]=[CH3COO-]+[OH-] |
| C.[Na+]>[CH3COO-]>[OH-]>[H+] |
| D.[CH3COO-]>[Na+]>[H+]>[OH-] |