题目内容
将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
| A.溶液的pH增大 | B.CH3COOH电离的百分率变大 |
| C.溶液的导电能力减弱 | D.溶液中c(OH-)减小 |
A
解析试题分析:在CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+。当加水稀释时,c(CH3COOH )、c(CH3COO-)、c(H+)都减小,电离平衡正向移动,使离子浓度又有所增大,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,所以溶液的pH增大;CH3COOH电离的百分率变大;溶液的导电能力减弱;因为在溶液中c(H+) ·c(OH-)=Kw不变。c(H+)减小,所以c(OH-)增大。当加入少量CH3COONa晶体时,盐电离产生的CH3COO-使c(CH3COO-)增大,电离平衡CH3COOH
CH3COO-+H+。当加水稀释时,c(CH3COOH )、c(CH3COO-)、c(H+)都减小,电离平衡正向移动,使离子浓度又有所增大,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,所以溶液的pH增大;CH3COOH电离的百分率变大;溶液的导电能力减弱;因为在溶液中c(H+) ·c(OH-)=Kw不变。c(H+)减小,所以c(OH-)增大。当加入少量CH3COONa晶体时,盐电离产生的CH3COO-使c(CH3COO-)增大,电离平衡CH3COOH CH3COO-+H+。向逆向移动,c(CH3COOH )、c(H+)都减小。c(H+)越小,溶液的pH增大。由于加入CH3COONa晶体抑制酸的电离,所以溶液中CH3COOH电离的百分率变小。因为溶液中的自由移动的离子浓度增大,所以溶液的导电性增强。因为在溶液中c(H+) ·c(OH-)=Kw不变。c(H+)减小,所以c(OH-)增大。故将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起溶液的pH增大。选项为A。
CH3COO-+H+。向逆向移动,c(CH3COOH )、c(H+)都减小。c(H+)越小,溶液的pH增大。由于加入CH3COONa晶体抑制酸的电离,所以溶液中CH3COOH电离的百分率变小。因为溶液中的自由移动的离子浓度增大,所以溶液的导电性增强。因为在溶液中c(H+) ·c(OH-)=Kw不变。c(H+)减小,所以c(OH-)增大。故将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起溶液的pH增大。选项为A。
考点:考查水及含有相同离子的盐对弱酸的电离平衡的影响的知识。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案常温下,下列各组比值为1∶2的是 ( )
| A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 |
| B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c (CH3COO-)之比 |
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是( )
H++OH-,下列叙述中正确的是( )
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
下列有关说法正确的是
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |
实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
关于强、弱电解质的有关叙述错误的是( )
| A.强电解质在水溶液中完全电离成阴、阳离子 |
| B.在溶液中,导电能力强的电解质是强电解质 |
| C.对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
下列说法正确的是( )
| A.25℃时 NH4Cl 溶液的 KW大于 100℃时 NaCl 溶液的 KW |
B.SO2通入碘水中,反应的离子方程式为 SO2+I2+2H2O=SO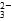 +2I-+4H+ +2I-+4H+ |
C.加入铝粉能产生 H2的溶液中,可能存在大量的 Na+、Ba2+、AlO 、NO 、NO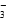 |
| D.100℃时,将 pH =2 的盐酸与 pH =12 的 NaOH 溶液等体积混合,溶液显中性 |
在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
| A.[Na+]=[CH3COO-]+[CH3COOH] |
| B.[H+]=[CH3COO-]+[OH-] |
| C.[Na+]>[CH3COO-]>[OH-]>[H+] |
| D.[CH3COO-]>[Na+]>[H+]>[OH-] |
某温度下 ,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |