题目内容
11.随着石油资源的日趋紧张.天然气资源的开发利用受到越来越多的关注,以天然气(主要成分是CH4)为原料经合成气(主要成分CO、H2)制化学品,是目前天然气转化利用的主要技术路线.而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒.请问答下列问题:
(1)[Fe(CO)5]中铁的化合价为0.写出铁原子的基态价电子排布式:3d64s2.
(2)与CO互为等电子体的分子和离子分别为N2和CN-(各举一种即可,填化学式),CO分子的结构式可表示成C≡O,该分子中含1个σ键2个π键.
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有CH4、CH3OH,CH3OH的熔、沸点比CH4的熔、沸点比高,其主要原因是CH3OH分子之间形成氢键,且为极性分子.
(4)CH3CHO分子中,-CH3中的碳原子采用sp3杂化方式,-CHO中的碳原子采用sp2杂化方式.
分析 (1)[Fe(CO)5]中铁原子与CO形成配位键;Fe的原子核外电子数为26,根据能量最低原理书写价电子排布式;
(2)原子数目相等、价电子总数也相等的微粒互为等电子体,等电子体的结构相似;
(3)碳原子采取sp3杂化,则分子中C原子杂化轨道数目为4,杂化轨道数目=σ键数+孤电子对数;CH3OH分子之间形成氢键,熔沸点高于甲烷的;
(4)CH3CHO分子中C原子均没有孤对电子,-CH3中的碳原子杂化轨道数目为4、-CHO中的碳原子杂化轨道数目为3.
解答 解:(1)[Fe(CO)5]中铁原子与CO形成配位键,Fe元素化合价为0价,Fe的原子核外电子数为26,基态电子排布式为[Ar]3d64s2,价电子排布式为:3d64s2,
故答案为:0;3d64s2;
(2)原子数目相等、价电子总数也相等的微粒互为等电子体,与CO互为等电子体的分子、离子分别为N2、CN-,
等电子体的结构相似,则CO与氮气分子结构相似,结构式为C≡O,该分子中含1个σ键、2个π键,.
故答案为:N2;CN-;C≡O;1;2;
(3)在CH4、CO、CH3OH三种物质中甲烷、甲醇中C原子杂化轨道数目为4,碳原子采取sp3杂化,CH3OH分子之间形成氢键,且为极性分子,则熔沸点高于甲烷的,
故答案为:CH4、CH3OH;CH3OH分子之间形成氢键,且为极性分子;
(4)CH3CHO分子中C原子均没有孤对电子,-CH3中的碳原子杂化轨道数目为4、-CHO中的碳原子杂化轨道数目为3,分别采取sp3杂化、sp2杂化,
故答案为:sp3;sp2.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、等电子体、化学键、分子结构与性质、杂化方式判断等,注意氢键对物质性质的影响.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列关于SiO2和CO2 的叙述中正确的是( )
| A. | 两者都是酸性氧化物,故均不与酸反应 | |
| B. | 两者都可以与NaOH溶液反应 | |
| C. | CO2 的溶沸点比SiO2高 | |
| D. | 两者都能与水反应生成对应的酸且碳酸的酸性大于硅酸 |
19.下列微粒中,电子层结构完全相同的一组是( )
| A. | S2-、Cl-、K+ | B. | Cl-、Br-、I- | C. | Na+、Mg2+、Cl- | D. | O2-、Mg2+、Cl- |
6.根据元素周期表和元素周期律,下列推断中错误的是( )
| A. | 砹是一种有色固体,它的气态氢化物很不稳定 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| C. | 铷的硫酸盐易溶解于水,其氢氧化物一定是强碱 | |
| D. | 氯化氢比溴化氢稳定,HClO4酸性强于HBrO4 |
16.2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德•埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )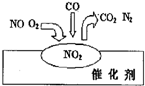

| A. | NO2是该过程的最终产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分是CO2和NO | |
| D. | 该催化转化的总反应方程式为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$ 4CO2+N2 |
3. 2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )
2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )
 2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )
2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )| A. | 它的分子式为C15H2205 | |
| B. | 青蒿素易发生加成反应和氧化反应 | |
| C. | 青蒿素在碱性条件下易发生水解反应 | |
| D. | 它在常见有机溶剂中的溶解度大于在水中的溶解度 |
20.下列离子方程式的书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 铜和稀硝酸反应:Cu+2H+═H2↑+Cu2+ | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O |
1.镁电池放电时电压高而平稳,镁电池成为人们研制的绿色电池,一种镁电池的反应式为xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4,下列说法中正确的是( )
| A. | 充电时MgxMo3S4只发生还原反应 | |
| B. | 放电时Mo3S4只发生氧化反应 | |
| C. | 充电时阳极反应式为 Mo3S42x--2xe-=Mo3S4 | |
| D. | 放电时负极反应式为xMg=xMg2+-2xe- |