题目内容
 如图是中学化学中某些物质之间的相互转化关系.已知C、D、G、H、K为单质,其他为化合物;A是一种常见的液态化合物,J为淡黄色固体,E对玻璃具有很强的腐蚀性;G、K是碳素钢中的两种重要元素,其中K含量少;E、F对应溶液的酸碱性相反,F的焰色反应为黄色.请按要求作答:
如图是中学化学中某些物质之间的相互转化关系.已知C、D、G、H、K为单质,其他为化合物;A是一种常见的液态化合物,J为淡黄色固体,E对玻璃具有很强的腐蚀性;G、K是碳素钢中的两种重要元素,其中K含量少;E、F对应溶液的酸碱性相反,F的焰色反应为黄色.请按要求作答:(1)写出化合物E的电子式:
(2)写出A与J反应的化学反应方程式:
(3)B与足量稀硝酸反应时,当参加反应的硝酸为2mol,反应中转移电子的物质的量为
(4)①以Pt为电极,由I、D以及F的溶液组成原电池,则负极的反应式为:
②若用此电池电解500mL 5mol/L的氯化钠溶液一段时间,两极各收集标准状况下气体3.36L,测得溶液的pH为
考点:无机物的推断
专题:推断题
分析:A是一种常见的液态化合物,J为淡黄色固体,二者相互反应生成F与单质D,F的焰色反应为黄色,说明含有Na元素,该反应是过氧化钠与水的反应,可推知A为H2O、J为Na2O2,F为NaOH,D为O2.水与H反应生成氧气与E,E对玻璃具有很强的腐蚀性,可推知H为Cl2、E为HCl.G、K是碳素钢中的两种重要元素,其中K含量少,则G为Fe,K为C,碳与水反应生成单质C与化合物I,则C为H2、I为CO,Fe与水反应生成化合物B与氢气,则B为Fe3O4,据此解答.
解答:
解:A是一种常见的液态化合物,J为淡黄色固体,二者相互反应生成F与单质D,F的焰色反应为黄色,说明含有Na元素,该反应是过氧化钠与水的反应,可推知A为H2O、J为Na2O2,F为NaOH,D为O2.水与H反应生成氧气与E,E对玻璃具有很强的腐蚀性,可推知H为Cl2、E为HCl.G、K是碳素钢中的两种重要元素,其中K含量少,则G为Fe,K为C,碳与水反应生成单质C与化合物I,则C为H2、I为CO,Fe与水反应生成化合物B与氢气,则B为Fe3O4,
(1)化合物E为HF,F原子与H原子之间形成1对共用电子对,其电子式为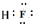 ,故答案为:
,故答案为: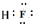 ;
;
(2)A与J反应的化学反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,故答案为:2H2O+2Na2O2=4NaOH+O2↑;
(3)B为Fe3O4,与足量稀硝酸反应时,生成Fe(NO3)3与NO,令生成Fe(NO3)3为xmol,当参加反应的硝酸为2mol,则生成NO为(2-3x)mol,根据电子转移守恒可知:xmol×(3-
)=(2-3x)mol×(5-2),解得x=
,故反应中转移电子的物质的量为(2-
×3 )mol×(5-2)=0.21mol,
故答案为:0.21;
(4)①以Pt为电极,由CO、氧气以及NaOH的溶液组成原电池,CO发生氧化反应,在负极失去电子,碱性条件下生成碳酸根,则负极的反应式为:CO-2e-+4OH-=CO32-+2H2O,
故答案为:CO-2e-+4OH-=CO32-+2H2O;
②若用此电池电解500mL 5mol/L的氯化钠溶液一段时间,两极各收集标准状况下气体3.36L,则:
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
2mol 22.4L
n(NaOH) 3.36L
所以,2mol:n(NaOH)=22.4L:3.36L,解得n(NaOH)=0.3mol,故c(NaOH)=
=0.6mol/L,
故溶液中c(H+)=
mol/L,则溶液pH=-lg
=13.78,
溶液中剩余NaCl为0.5L×5mol/L-0.3mol=0.2mol,若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),其物质的量=
=0.2mol,n(NaOH):(CO2)=3:2,由于1:1<n(NaOH):(CO2):<2:1,故生成碳酸钠、碳酸氢钠,令二者的物质的量分别为:amol、bmol,由Na元素、C元素守恒可得:a+b=0.2,2a+b=0.3,解得a=0.1、b=0.1,碳酸根、碳酸氢根水解,溶液呈碱性,碳酸根的水解程度大于碳酸氢根,故c(Cl-)>c(HCO3-)>c(CO32-),溶液中钠离子浓度不变,其浓度最大,则所得溶液中各离子浓度大小关系为:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
故答案为:13.78;c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(1)化合物E为HF,F原子与H原子之间形成1对共用电子对,其电子式为
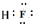 ,故答案为:
,故答案为: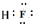 ;
;(2)A与J反应的化学反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,故答案为:2H2O+2Na2O2=4NaOH+O2↑;
(3)B为Fe3O4,与足量稀硝酸反应时,生成Fe(NO3)3与NO,令生成Fe(NO3)3为xmol,当参加反应的硝酸为2mol,则生成NO为(2-3x)mol,根据电子转移守恒可知:xmol×(3-
| 8 |
| 3 |
| 9 |
| 14 |
| 9 |
| 14 |
故答案为:0.21;
(4)①以Pt为电极,由CO、氧气以及NaOH的溶液组成原电池,CO发生氧化反应,在负极失去电子,碱性条件下生成碳酸根,则负极的反应式为:CO-2e-+4OH-=CO32-+2H2O,
故答案为:CO-2e-+4OH-=CO32-+2H2O;
②若用此电池电解500mL 5mol/L的氯化钠溶液一段时间,两极各收集标准状况下气体3.36L,则:
2NaCl+2H2O
| ||
2mol 22.4L
n(NaOH) 3.36L
所以,2mol:n(NaOH)=22.4L:3.36L,解得n(NaOH)=0.3mol,故c(NaOH)=
| 0.3mol |
| 0.5L |
故溶液中c(H+)=
| 10-14 |
| 0.6 |
| 10-14 |
| 0.6 |
溶液中剩余NaCl为0.5L×5mol/L-0.3mol=0.2mol,若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),其物质的量=
| 4.48L |
| 22.4L/mol |
故答案为:13.78;c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评:本题考查无机物推断,涉及Na、F、C、Fe元素单质化合物性质以及常用化学用语、氧化还原反应计算、原电池、电解原理、混合物计算、离子浓度比较等,(3)中利用Fe的平均化合价,简化计算,(4)中离子浓度比较为易错点,学生容易忽略剩余的NaCl.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
已知AgI为黄色沉淀,AgCl为白色沉淀.25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol?L-1,AgCI饱和溶液中c(Ag+)为1.30×10-5mol?L-1.若在5mL含有KC1和KI浓度均为0.01mol?L-1的混合溶液中,滴加8mL0.0l mol?L-1的AgNO3溶液,则下列叙述中不正确的是( )
| A、溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Cl-)>c(I-)>c(Ag+) |
| B、溶液中先产生的是AgI沉淀 |
| C、AgCl的KSP的数值为1.69×10-10 |
| D、若在AgI悬浊液中滴加一定量的KCl溶液,黄色沉淀会转变成白色沉淀 |
下列离子方程式书写正确的是( )
| A、用氯化铁溶液做腐蚀液制印刷电路板:Cu+2Fe3+=Cu2++2Fe2+ |
| B、用醋酸除去暖瓶胆内水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、加入明矾后使浊水变清:Al3++3H2O=Al(OH)3↓+3H+ |
| D、碳酸氢钠溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
下列叙述正确的是( )
| A、0.1mol?L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| C、pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等 |
| D、在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
下列叙述正确的是( )


| A、电镀时,通常把待镀的金属制品作阴极 |
| B、氢氧燃料电池(酸性电解质)中O2通入负极 |
| C、图中电子由Cu极流向Zn,盐桥中的Cl-移向CuSO4溶液 |
| D、在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |