题目内容
14.将5.55 g CaCl2与6.00g Na2CO3共同溶于足量的水中.搅拌均匀.生成沉淀的质量是多少?分析 据此根据反应的化学方程式CaCl2+Na2CO3═CaCO3↓+2NaCl列式进行过量判断,算出生成沉淀的质量,由此分析解答.
解答 解:设生成沉淀质量为xg,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 100
5.55 g 6.00g xg
因为:$\frac{5.55}{111}<\frac{6}{106}$,所以碳酸钠过量,根据氯化钙求沉淀的质量,
$\frac{111}{5.55}=\frac{100}{x}$,解之得x=5g,
答:生成沉淀的质量是5g.
点评 本题难度不大,掌握利用化学方程式计算即可正确解答本题,过量问题的判断是解答本题的前提和关键.

练习册系列答案
相关题目
4.下列各组混合物中,无论以何种比例混合,取n mol使之充分燃烧,耗氧量为定值的是( )
| A. | CH4、C2H6 | B. | C2H4、C3H6 | C. | C2H4、C2H4O | D. | C4H8、C6H12O6 |
5.下列化学实验事实及其解释都正确的是( )
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | |
| B. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而增大与氢氧化溶液的接触面积,从而加快油脂皂化反应速率 | |
| D. | 某溶液用硝酸酸化无现象,再滴加氯化钡溶液有白色沉淀产生,说明溶液中有SO42- |
9.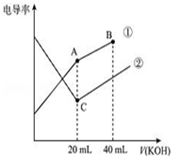 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)小于A点水电离的 c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
19.物质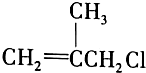 是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )
是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )
①能使Br2的CCl4溶液褪色 ②能使酸性KMnO4溶液褪色 ③在一定条件下可以聚合成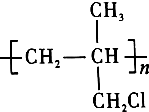
④在NaOH溶液中加热可以生成不饱和醇类 ⑤在NaOH的醇溶液中加热,可发生消去反应 ⑥与AgNO3溶液反应生成白色沉淀.
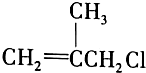 是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )
是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )①能使Br2的CCl4溶液褪色 ②能使酸性KMnO4溶液褪色 ③在一定条件下可以聚合成
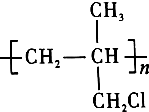
④在NaOH溶液中加热可以生成不饱和醇类 ⑤在NaOH的醇溶液中加热,可发生消去反应 ⑥与AgNO3溶液反应生成白色沉淀.
| A. | ①②③④ | B. | ⑤⑥ | C. | ②④⑥ | D. | 全部 |
19.钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为CO+PdCl2+H2O═CO2+Pd↓+2HCl.下列说法正确的是( )
| A. | CO的还原性强于Pd | |
| B. | 反应中PdCl2被氧化 | |
| C. | 若反应生成22.4 L CO2,则转移电子的物质的量一定为2 mol | |
| D. | CO气体只有在高温下才能表现出还原性 |
