题目内容
(19分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
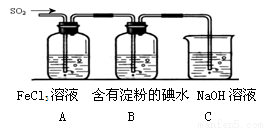
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 。
(2)装置C的作用是 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成 ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法 (填“合理”或“不合理”),理由是 。
(5)能表明I-的还原性弱于SO2的现象是 。
(1)浓盐酸(1分,答盐酸也可得分),抑制氯化铁水解(2分);
(2)吸收SO2尾气,防止污染空气;(2分) (3)过滤(2分);B、F;(2分)
(4)①2Fe3++SO2+2H2O=SO42-+2Fe2++4H+(2分) ②取A中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红(3分,按取样、加试剂、现象给分) ③不合理(1分),硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验(2分) (5)B中蓝色溶液褪色(2分)
【解析】
试题分析:(1)氯化铁溶于水水解生成氢氧化铁和氯化氢,因此为防止铁离子水解,配制氯化铁溶液时需要将氯化铁先溶解在盐酸中,然后在稀释。
(2)二氧化硫有毒,属于大气污染物,直接排放污染大气,因此C装置中氢氧化钠的作用是吸收SO2尾气,防止污染空气。
(3)从溶液中获得晶体,需要蒸发、冷却结晶、过滤、自然干燥。蒸发操作中需要要到的仪器是蒸发皿、酒精灯、玻璃棒,过滤需要的仪器是漏斗、烧杯和玻璃棒,因此不需要的是石棉网和坩埚,答案选BF。
(4)①铁离子具有氧化性,能把SO2氧化生成硫酸,反应的离子方程式为2Fe3++SO2+2H2O=SO42-+2Fe2++4H+。
②亚铁离子具有还原性,能被氧化生成铁离子,而铁离子能与KSCN溶液发生反应显红色,据此设计实验方案,即取A中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,即可说明含有亚铁离子。
③硝酸是氧化性酸,而SO2易溶于水,因此硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,实验方案是不合理的。
(5)根据反应I2+SO2+2H2O=2HI+H2SO4可知,二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,据此可以说明碘离子的还原性弱于SO2。
考点:考查SO2性质实验方案设计与探究

 53随堂测系列答案
53随堂测系列答案下列叙述I和II均正确并有因果关系的是
选项 | 叙述I | 叙述II |
A | 实验室常用Al2(SO4)3溶液与氨水溶液制备Al(OH)3沉淀 | Al(OH)3不溶于碱 |
B | NaHCO3为强碱弱酸盐 | NaHCO3 溶液显碱性 |
C | SO2具有氧化性 | SO2可用品红溶液检验 |
D | Fe(OH)3胶体有丁达尔效应 | Fe(OH)3胶体可以用FeCl3浓溶液与NaOH溶液反应制得 |
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液 | 均有固体析出 | 蛋白质均发生变性 |
B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
C | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
D | 向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |

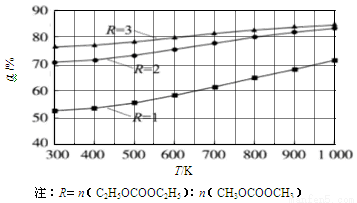
 2 CH3OCOOC2H5(g) ΔH1
2 CH3OCOOC2H5(g) ΔH1