题目内容
16.下列气体中,不能用碱石灰干燥的是( )| A. | CO | B. | NH3 | C. | Cl2 | D. | N2 |
分析 用干燥剂干燥气体时,总的原则是:中性干燥剂既可以用来干燥酸性气体又可以用来干燥碱性气体;酸性干燥剂不能用来干燥碱性气体;碱性干燥剂不能用来干燥酸性气体;碱石灰是氧化钙和氢氧化钠的混合物,是碱性干燥剂.
解答 解:碱石灰是氧化钙和氢氧化钠的混合物,是碱性干燥剂,不能用来干燥酸性气体,CO和氮气为中性气体,氨气是碱性气体,均可以用碱石灰干燥,而氯气是酸性气体,不能用碱石灰干燥,故选C.
点评 本题考查气体的净化和干燥,难度不大,注意常见的干燥剂有:浓硫酸、碱石灰;其中,浓硫酸是酸性干燥剂,碱石灰是碱性干燥剂.

练习册系列答案
相关题目
6.下列有关物质的性质类比正确的是( )
| A. | 已知Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,则Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应 | |
| C. | CaS03与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2 | |
| D. | 已知H2O2能氧化I一,可知H2O2也能氧化Cl- |
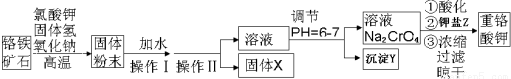
8.硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅.工艺流程如下:
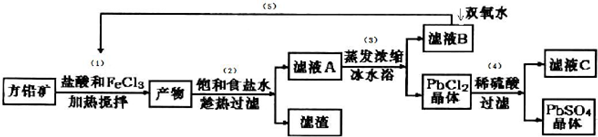
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2C1-(aq)?PbCl42-(aq)△H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7.
(I )流程中加入盐酸可以控制溶液的pH<1.9,主要目的是抑制Fe3+的水解.反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为2Fe3++PbS=PbCl2+S+2Fe2+.
(II) 步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出(请用平衡移动原理解释)
(III )上述流程中可循环利用的物质有FeCl3、HCl.
(IV)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染.水溶液中铅的存在形态主要有
Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的铅浓度分数α与溶液pH 变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为Pb(OH)3-+HO-=Pb(OH)42-..
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
Ⅰ.由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是加入试剂,Pb2+的浓度转化率为$\frac{(0.1-0.004)}{0.1}$×1005%=96%,Fe3+的浓度转化率为$\frac{0.12-0.04}{0.12}$×100%=67%,所以去除Pb2+比Fe3+效果好.
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+?D2Pb(s)+2H+,则脱铅时最合适的pH约为B.
A.4 B.6 C. 10 D. 12.

已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2C1-(aq)?PbCl42-(aq)△H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7.
(I )流程中加入盐酸可以控制溶液的pH<1.9,主要目的是抑制Fe3+的水解.反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为2Fe3++PbS=PbCl2+S+2Fe2+.
(II) 步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出(请用平衡移动原理解释)
(III )上述流程中可循环利用的物质有FeCl3、HCl.
(IV)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染.水溶液中铅的存在形态主要有
Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的铅浓度分数α与溶液pH 变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为Pb(OH)3-+HO-=Pb(OH)42-..
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+?D2Pb(s)+2H+,则脱铅时最合适的pH约为B.
A.4 B.6 C. 10 D. 12.
5.半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
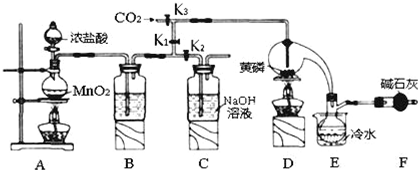
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生 成 H3PO3和HC1;③PCl3遇O2会生成P0Cl3,P0Cl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)F中碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.

已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生 成 H3PO3和HC1;③PCl3遇O2会生成P0Cl3,P0Cl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)F中碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
6.W、X、Y、Z均为短周期主族元素,原子序数依次增加,W元素的周期序数、族序数均相等,X、Y、Z的最外层电子数分别为6、2、6.下列说怯正确的是( )
| A. | 原子半径:Z>Y>X>W | |
| B. | Z单质在过量的X单质中燃烧生成ZX3 | |
| C. | 元素Y和W能形成离子化合物 | |
| D. | 元素W、X各自最高和最低化合价的代数和分别为0、4 |
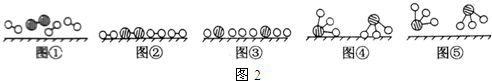
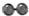 、
、 、
、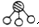 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.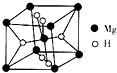 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.