题目内容
铯的原子序数是55是第6周期ⅠA族元素,试推断下列内容
(1)铯的原子核外共有 层电子,最外层有 个电子.
(2)铯跟水起剧烈反应,放出 ;同时生成的溶液使石蕊显 色,因为 .
(3)碳酸铯的水溶液使酚酞显 色,因为 .
(4)同位素138Cs原子核里有 个中子.
(5)原子序数为54的元素位于元素周期表中第 周期 族,因为从原子结构来看, .
(1)铯的原子核外共有
(2)铯跟水起剧烈反应,放出
(3)碳酸铯的水溶液使酚酞显
(4)同位素138Cs原子核里有
(5)原子序数为54的元素位于元素周期表中第
考点:碱金属的性质
专题:元素周期律与元素周期表专题
分析:(1)元素的周期序数等于电子层数;主族序数等于最外层电子数;
(2)钠和铯同处于第IA族,根据同主族元素性质的相似性和递变性来分析;
(3)碳酸铯是强碱弱碱盐,水解显碱性;
(4)根据原子的质量数=质子数+中子数来计算;
(5)根据铯的原子序数是55是第6周期ⅠA族元素,故54号元素处于第5周期0族,因为同一周期从左至右,最外层电子数从1个递增到8个.
(2)钠和铯同处于第IA族,根据同主族元素性质的相似性和递变性来分析;
(3)碳酸铯是强碱弱碱盐,水解显碱性;
(4)根据原子的质量数=质子数+中子数来计算;
(5)根据铯的原子序数是55是第6周期ⅠA族元素,故54号元素处于第5周期0族,因为同一周期从左至右,最外层电子数从1个递增到8个.
解答:
解:(1)铯元素处于第6周期,而元素的周期序数等于电子层数,故铯原子有6个电子层;铯元素处于第IA族,而主族序数等于最外层电子数,故铯原子的最外层有1个电子,故答案为:6;1;
(2)钠与水反应:2Na+2H2O=2NaOH+H2↑,钠和铯同处于第IA族,性质有相似性和递变性,故铯与水反应:2Cs+2H2O=2CsOH+H2↑,反应放出氢气,生成CsOH 是强碱,能使紫色石蕊变蓝,
故答案为:氢气;蓝;生成CsOH是强碱;
(3)碳酸铯是强碱弱酸盐,水解显碱性:CO32-+H2O?HCO3-+OH-,故能使酚酞变红,故答案为:红;碳酸铯水解显碱性:CO32-+H2O?HCO3-+OH-;
(4)原子的质量数=质子数+中子数,同位素138Cs原子核中含55个质子,故中子数=质量数-质子数=138-55=83,故答案为:83;
(5)根据铯的原子序数是55是第6周期ⅠA族元素,故54号元素处于第5周期0族,因为同一周期从左至右,最外层电子数从1个递增到8个,即从第IA族递增到第VIIA族,然后是0族,
故答案为:5;0;最外层电子数从1个递增到8个,即从第IA族递增到第VIIA族,然后是0族.
(2)钠与水反应:2Na+2H2O=2NaOH+H2↑,钠和铯同处于第IA族,性质有相似性和递变性,故铯与水反应:2Cs+2H2O=2CsOH+H2↑,反应放出氢气,生成CsOH 是强碱,能使紫色石蕊变蓝,
故答案为:氢气;蓝;生成CsOH是强碱;
(3)碳酸铯是强碱弱酸盐,水解显碱性:CO32-+H2O?HCO3-+OH-,故能使酚酞变红,故答案为:红;碳酸铯水解显碱性:CO32-+H2O?HCO3-+OH-;
(4)原子的质量数=质子数+中子数,同位素138Cs原子核中含55个质子,故中子数=质量数-质子数=138-55=83,故答案为:83;
(5)根据铯的原子序数是55是第6周期ⅠA族元素,故54号元素处于第5周期0族,因为同一周期从左至右,最外层电子数从1个递增到8个,即从第IA族递增到第VIIA族,然后是0族,
故答案为:5;0;最外层电子数从1个递增到8个,即从第IA族递增到第VIIA族,然后是0族.
点评:本题考查了元素性质的相似性和递变性,难度不大.

练习册系列答案
相关题目
下列装置所示的实验不能达到目的是( )

| A、实验一:验证二氧化碳密度大于空气,不支持燃烧 |
| B、实验二:探究燃烧需要的条件 |
| C、实验三:探究质量守恒定律 |
| D、实验四:测量空气中氧气所占的体积分数 |
下列萃取与分液相结合进行的操作(用苯从碘水中萃取碘单质,且已知苯的密度比水小)中错误的是( )
| A、碘水和苯加入分液漏斗后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡,并不时地放气 |
| B、静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) |
| C、打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出,及时关闭活塞 |
| D、最后继续打开活塞,另用烧杯在分液漏斗的下口承接并保存上层液体 |
分别燃烧下列各组物质中的两种有机化合物,所得CO2和H2O的物质的量之比相同的有( )
| A、乙烯、丁二烯 |
| B、乙醇、乙醚 |
| C、苯、苯酚 |
| D、醋酸、葡萄糖 |
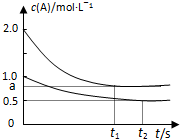 向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( ) | 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)<v(逆) |
可以说明乙酸是弱酸的事实是( )
| A、乙酸不能使酚酞溶液变红色 |
| B、0.1 mol?L-1的乙酸溶液pH>1 |
| C、乙酸能使紫色石蕊试液变红色 |
| D、乙酸和Na2CO3反应可放出CO2 |
在pH都等于9的KOH和CH3COOK两种溶液中,设由水电离产生的OH-离子浓度分别为Xmol/L与Ymol/L,则X和Y的关系为( )
| A、X=Y |
| B、Y=10-4 X |
| C、X=10-4 Y |
| D、X>Y |
下列措施或事实不是因平衡移动引起的是( )
| A、新制的氯水在光照下颜色变浅 |
| B、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| C、H2、I2、HI平衡混合气加压后颜色变深 |
| D、在合成氨的反应中,加压有利于氨的合成 |
实验室制Cl2的反应为4HCl(浓)+MnO2═MnCl2+C12↑+2H2O,下列说法错误的是( )
| A、还原剂是HCl,氧化剂是MnO2 |
| B、每生成1 molCl2,转移电子的物质的量为2 mol |
| C、每消耗1 molMnO2,起还原剂作用的HCl消耗4mol |
| D、生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |