题目内容
8.标准状况下,n L NH3气体溶于m mL H2O中,得密度为ρ g•cm-3的R L的氨水,则此氨水的物质的量浓度为( )| A. | $\frac{n}{2.4R}$ mol•L-1 | B. | $\frac{1000nρ}{17n+22.4m}$mol•L-1 | ||
| C. | $\frac{n}{22.4}$mol•L-1 | D. | $\frac{1000ρ}{17n+22.4m}$mol•L-1 |
分析 根据n=$\frac{V}{{V}_{m}}$、m=nM计算出氨气的质量,m mL水的质量约为mg,从而可知所得溶液质量,然后根据V=$\frac{m}{ρ}$计算出氨水体积,最后根据c=$\frac{n}{V}$计算出该氨水的物质的量浓度.
解答 解:标准状况下nL氨气的物质的量为:$\frac{nL}{22.4L/mol}$=$\frac{n}{22.4}$mol,该氨气的质量为:17g/mol×$\frac{n}{22.4}$mol=$\frac{17n}{22.4}$g,
m mL水的质量约为mg,则所得溶液质量为:mg+$\frac{17n}{22.4}$g,所得溶液的体积为:$\frac{\frac{17n}{22.4}g+mg}{1000ρg/L}$=$\frac{17n+22.4m}{22400ρ}$L,
所以该氨水的物质的量浓度为:$\frac{\frac{n}{22.4}mol}{\frac{17n+22.4m}{22400ρ}}$=$\frac{1000ρn}{17n+22.4m}$mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算氨水的体积为解答关键,注意熟练掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.如图表示某反应的能量变化,对于该图的理解,你认为一定正确的是( )
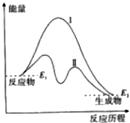

| A. | 曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 | |
| B. | 曲线Ⅱ可表示反应2NH3$?_{高温高压}^{催化剂}$N2+3H2的能量变化 | |
| C. | 该反应不需要加热就能发生 | |
| D. | 该反应的△H=E2-E1 |
19.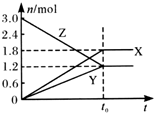 在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
 在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A. | 该反应的化学方程式为:3Z═3X+2Y | B. | t0时,X、Y、Z的质量不再改变 | ||
| C. | t0时,Z的浓度为1.2 mol/L | D. | t0时,反应停止,反应速率为0 |
16.某恒容密闭容器中充入等物质的量的A 和B,一定温度下发生反应A(s)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
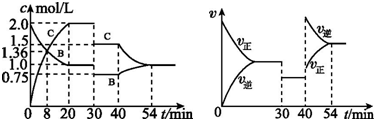
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 30 min~40 min 间该反应使用了催化剂 | |
| B. | 反应方程式中的x=2,正反应为吸热反应 | |
| C. | 30 min 时条件的变化是降低压强,40 min 时条件的变化是升高温度 | |
| D. | 前8 min A 的平均反应速率为0.08 mol•L-1•min-1 |
3.将充有m mL NO和n mL NO2的量筒倒立于水槽中,然后通入m mL O2,若m<n,则充分反应后,量筒内气体的体积为( )
| A. | 3(m-n) mL | B. | $(m+\frac{n}{3})$ mL | C. | $\frac{n-m}{3}$ mL | D. | $\frac{4n-m}{12}$ mL |
13.某研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质和用途,进行了如下图所示实验:
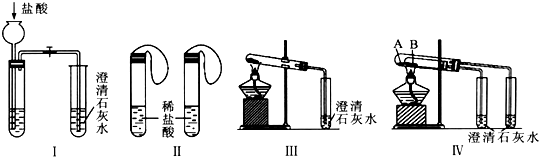
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是NaHCO3,实验现象是右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊.
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的是Ⅱ、Ⅲ、Ⅳ(填装置序号).其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是Ⅱ.
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,Ⅲ能否达到实验目的?若能,请说明其计算所需的数据能;若不能,请简要说明理由固体样品的质量和沉淀总质量(或反应前后固体的质量).
(4)同学们将两种固体分别配制成0.5 mol•L-1的溶液,设计如下方案并对反应现象作出预测:

(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是NaHCO3,实验现象是右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊.
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的是Ⅱ、Ⅲ、Ⅳ(填装置序号).其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是Ⅱ.
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,Ⅲ能否达到实验目的?若能,请说明其计算所需的数据能;若不能,请简要说明理由固体样品的质量和沉淀总质量(或反应前后固体的质量).
(4)同学们将两种固体分别配制成0.5 mol•L-1的溶液,设计如下方案并对反应现象作出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
20.下列各组物质在一定条件下发生反应时,硝酸或硫酸既表现出氧化性又表现出酸性的是( )
| A. | 稀硝酸和碳酸钠 | B. | 氧化铜和稀硝酸 | C. | 碳和浓硫酸 | D. | 铜和浓硝酸 |
17.关于下列变化过程的有关叙述正确的是( )


| A. | 苯氧乙酸甲酯的分子式为C9H10O3 | |
| B. | 苯氧乙酸与邻羟基苯乙酸不互为同分异构体 | |
| C. | 苯酚和邻羟基苯乙酸可用FeCl3溶液检验 | |
| D. | ClCH2COOH与足量烧碱溶液共热所得有机物为HOCH2COOH |
18.乙苯是一种用途广泛的有机原料,可制备多种化工产产品.
制备苯乙烯(原理如图所示):
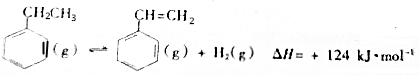
(1)部分化学键的键能如下表:
根据反应的能量变化,计算x=612KJ/mol.
(2)工业上,在恒压设备中进行反应时,常在乙苯蒸气中通入一定量的水蒸气,用化学平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率..
制备苯乙烯(原理如图所示):
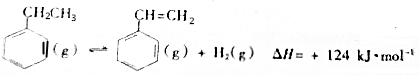
(1)部分化学键的键能如下表:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应时,常在乙苯蒸气中通入一定量的水蒸气,用化学平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率..