题目内容
19.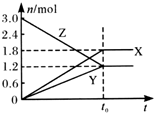 在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A. | 该反应的化学方程式为:3Z═3X+2Y | B. | t0时,X、Y、Z的质量不再改变 | ||
| C. | t0时,Z的浓度为1.2 mol/L | D. | t0时,反应停止,反应速率为0 |
分析 A、根据X、Y、Z物质的量的变化判断反应物、产物,利用物质的量之比等于化学计量数之比确定化学计量数,据此书写化学方程式;
B、化学平衡时的特征作判断;
C、根据物质的量与体积计算浓度;
D、根据可逆反应的特征判断.
解答 解:A、由图可知,X、Y的物质的量增大,为生成物,Z物质的量减小,为反应物,到平衡后,X生成1.8mol,Y生成1.2mol,Z反应1.8mol,X、Y、Z的化学计量数之比=1.8:1.2:1.8=3:2:3,则反应的化学方程式为:3Z?3X+2Y,是可逆反应,故A错误;
B、化学平衡时各组分的浓度不再随时间变化而变化,故X、Y、Z的质量也不再改变,故B正确;
C、根据图象可知平衡时Z的浓度为$\frac{1.2mol}{2L}$=0.6mol/L,故C错误;
D、根据可逆反应平衡的特征可知,反应处于平衡时正逆反应速率相等,但不等于零,故D错误;
故选B.
点评 本题考查了根据图象写化学方程式、计算浓度及运用化学平衡的特征解决问题,难度不大,主要是准确理解图象中有关信息.

练习册系列答案
相关题目
14.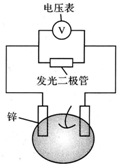 留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下
留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下
对甲同学提出的问题,乙同学的解释不正确的是( )
 留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下
留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下| 实验序号 | 电极材料 | 水果种类 | 电极间距离/cm | 电压/mV |
| 1 | 锌铜 | 菠萝 | 3 | 900 |
| 2 | 锌铜 | 苹果 | 3 | 650 |
| 3 | 锌铜 | 柑橘 | 3 | 850 |
| 4 | 锌铜 | 西红柿 | 3 | 750 |
| 5 | 锌铝 | 菠萝 | 3 | 650 |
| 6 | 锌铝 | 苹果 | 3 | 450 |
| 甲同学 | 乙同学 | |
| A | 实验6中负极电极反应式如何写? | Al-3e-=Al3+ |
| B | 实验1,5中电流方向为什么相反? | 1中锌为负极,电流由铜经导线流向锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
| C | 水果电池的电压与哪些因素有关? | 只跟水果的类型有关 |
| D | 实验中发光二极管不亮,如何使它亮起来 | 可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
| A. | A | B. | B | C. | C | D. | D |
4.可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的操作方法为( )
| A. | 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 混合气体通过盛有蒸馏水的洗气瓶 | |
| D. | 混合气体通过盛有NaOH溶液的洗气瓶 |
11.某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体生成.学生猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明CaCO3以外的两种成分.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗、漏斗架;2 mol•L-1盐酸、2mol•L-1NaOH溶液、2%的KSCN溶液.
(1)将实验方案用以下流程示意图表示,试写出每步所用试剂的名称或化学式.
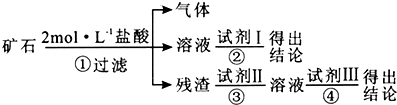
试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,叙述实验操作,预期现象和结论.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗、漏斗架;2 mol•L-1盐酸、2mol•L-1NaOH溶液、2%的KSCN溶液.
(1)将实验方案用以下流程示意图表示,试写出每步所用试剂的名称或化学式.

试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,叙述实验操作,预期现象和结论.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取适量矿石研细,加 足量2 mol•L-1盐酸 | 有大量无色气体生成,得棕黄 色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | ||
| ④ |
8.标准状况下,n L NH3气体溶于m mL H2O中,得密度为ρ g•cm-3的R L的氨水,则此氨水的物质的量浓度为( )
| A. | $\frac{n}{2.4R}$ mol•L-1 | B. | $\frac{1000nρ}{17n+22.4m}$mol•L-1 | ||
| C. | $\frac{n}{22.4}$mol•L-1 | D. | $\frac{1000ρ}{17n+22.4m}$mol•L-1 |
9.铁的常见化合价有+2和+3.据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物.该化合物可以表示为( )
| A. | FeO•3Fe2O3 | B. | 2FeO•3Fe2O3 | C. | FeO•2Fe2O3 | D. | 2FeO•Fe2O3 |
 .
. 工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.
工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.