题目内容
下列描述或化学用语书写错误的是( )
| A、向Fe(OH)3胶体中滴加稀硫酸,先生成红褐色沉淀,后沉淀逐渐溶解 |
| B、向铜粉中加入稀硫酸,铜粉不溶解,再加入硝酸钾固体,铜粉逐渐溶解 |
| C、向明矾(KAl(SO4)2?12H2O)溶液中滴入Ba(OH)2溶液,SO42-恰好完全沉淀时的离子方程式为:Ba2++3OH-+Al3++SO42-═BaSO4↓+Al(OH)3↓ |
| D、氯碱工业和金属钠的冶炼都用到了NaCl,阳极上发生的电极反应都是:2Cl-+2e-=Cl2↑ |
考点:胶体的重要性质,离子方程式的书写,电解原理,铜金属及其重要化合物的主要性质
专题:基本概念与基本理论
分析:A.胶体具有均一稳定性,加入电解质会使胶体发生聚沉,氢氧化铁胶体逐滴加入溶液,先产生沉淀后沉淀溶解,说明先胶体聚沉,后能溶解沉淀;
B.依据金属活动顺序表分析,铜和稀硫酸不反应,加入硝酸铜溶液中稀硝酸具有强氧化性能氧化铜,铜粉溶解;
C.反应生成偏铝酸根;
D.氯碱工业阳极反应为2C1--2e-=C12↑,金属钠的冶炼阳极反应为2C1--2e-=C12↑.
B.依据金属活动顺序表分析,铜和稀硫酸不反应,加入硝酸铜溶液中稀硝酸具有强氧化性能氧化铜,铜粉溶解;
C.反应生成偏铝酸根;
D.氯碱工业阳极反应为2C1--2e-=C12↑,金属钠的冶炼阳极反应为2C1--2e-=C12↑.
解答:
解:A.加入稀硫酸是电解质溶液,会引起氢氧化铁胶体聚沉,继续加入稀硫酸,氢氧化铁沉淀会溶解,故A正确;
B.铜和稀硫酸不反应,加入硝酸铜溶液中稀硝酸具有强氧化性能氧化铜,铜粉溶解,故B正确;
C.反应生成偏铝酸根:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故C错误;
D.氯碱工业阳极反应为2C1--2e-=C12↑,金属钠的冶炼阳极反应为2C1--2e-=C12↑,阳极反应都是:2C1--2e-=C12↑,故D正确.
故选C.
B.铜和稀硫酸不反应,加入硝酸铜溶液中稀硝酸具有强氧化性能氧化铜,铜粉溶解,故B正确;
C.反应生成偏铝酸根:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故C错误;
D.氯碱工业阳极反应为2C1--2e-=C12↑,金属钠的冶炼阳极反应为2C1--2e-=C12↑,阳极反应都是:2C1--2e-=C12↑,故D正确.
故选C.
点评:本题考查离子方程式的书写,题目难度中等,本题中注意把握物质的性质以及反应的过量问题,为易错点.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
如下:X
酸性氧化物→还原性盐;表示物质通过一步反应的转化关系,下列说法正确的是( )
| O2 |
| A、X可能是Si单质 |
| B、X可能是含S元素的化合物 |
| C、酸性氧化物可能为CO2 |
| D、还原性盐可能为FeCl3 |
将一定量的硫化铵固体置于恒容密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH4HS(s)?NH3(g)+H2S(g),下列选项中不能用来判断该反应已达平衡状态的是( )
| A、v正(NH3)=v逆(H2S) |
| B、密闭容器中混合气体的密度不变 |
| C、密闭容器中的压强不变 |
| D、密闭容器中氨气的体积分数不变 |
“水过鸭背不留珠”指的是鸭子的羽毛不会被水浸湿,这与鸭子羽毛表面的某种有机物有关,该种有机物可能是( )
| A、油脂 | B、葡萄糖 | C、蔗糖 | D、甘油 |
通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似.有关NCl3分子的下列说法中正确的是( )
| A、是由极性键形成的非极性分子 |
| B、所有N-Cl键的键长均相等 |
| C、Cl-N-Cl的键角是120° |
| D、比NF3键能更大,更稳定 |
常温下列各种溶液中,可能大量共存的离子组是( )
| A、pH=0的溶液中:Fe2+、NO3-、SO42-、I- |
| B、由水电离出的c(H+)=1×10-13mol?L-1的溶液中:Na+、AlO2-、S2-、CO32- |
| C、含有大量Fe3+的溶液中:Na+、I-、K+、NO3- |
| D、能使pH试纸显红色的溶液:Mg2+、SO42-、Na+、Cl- |
下列反应的离子方程式正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、钠加入到足量的水中:Na+2H2O=Na++2OH-+H2↑ |
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ |
| D、金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ |
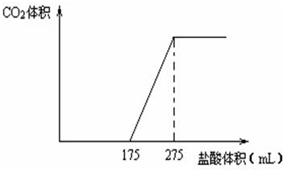 取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如下图所示.试回答下列问题:
取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如下图所示.试回答下列问题: 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答: