题目内容
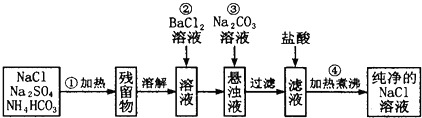
Ⅰ.如表是元素周期表的一部分,X、Y、Z、W、M均为短周期元素,X、W的质子数之和为23.回答下列问题:
(1)M、Z、W的原子半径由大到小: (填元素符号)
(2)比较X、Y的氢化物的稳定性由强到弱: ,Z和W最高价氧化物对应水化物酸性由强到弱 .(填化学式)
(3)1mol Z的最高价氧化物中含有 mol 共价键.
(4)请写出M与NaOH溶液反应的离子方程式: ;氧化剂的物质名称是 .
Ⅱ.通常情况下,微粒A和B为分子,C为5核阳离子,E为单核阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.写出A、B、E三种微粒反应的离子方程式: .
| X | Y | |||
| M | Z | W |
(2)比较X、Y的氢化物的稳定性由强到弱:
(3)1mol Z的最高价氧化物中含有
(4)请写出M与NaOH溶液反应的离子方程式:
Ⅱ.通常情况下,微粒A和B为分子,C为5核阳离子,E为单核阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.写出A、B、E三种微粒反应的离子方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Ⅰ.图为短周期的一部分,根据元素在周期表中的位置可知,X、Y在第二周期,Z、W在第三周期,设X的原子序数为x,则W的原子序数为x+9,由X、W的质子数之和为23,所以x+x+9=23,解得x=7,故X为N,Y为F,M为Al,Z为Si,W为S,据此解答;
Ⅱ.常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-,再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,从而得出答案.
Ⅱ.常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-,再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,从而得出答案.
解答:
解:Ⅰ.图为短周期的一部分,根据元素在周期表中的位置可知,X、Y在第二周期,Z、W在第三周期,设X的原子序数为x,则W的原子序数为x+9,由X、W的质子数之和为23,所以x+x+9=23,解得x=7,故X为N,Y为F,M为Al,Z为Si,W为S,
(1)同周期自左而右原子半径减小,故原子半径:Al>Si>S,故答案为:Al>Si>S;
(2)同周期自左而右元素非金属性增强,故非金属性F>N,非金属性越强氢化物越稳定,故氢化物的稳定性:HF>NH3,同周期自左而右元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强,故酸性H2SO4>H2SiO3,故答案为:HF>NH3;H2SO4>H2SiO3;
(3)Si与O形成4条共价键,1molSi的最高价氧化物中含有4mol共价键,故答案为:4;
(4)Al与NaOH反应生成偏铝酸钠和氢气,其中水做氧化剂,其反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑ 水;
Ⅱ.常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-,再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,
A为H2O、B为NH3,E为Mg2+或Al3+,A、B、E三种微粒反应的离子方程式为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+,
故答案为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+.
(1)同周期自左而右原子半径减小,故原子半径:Al>Si>S,故答案为:Al>Si>S;
(2)同周期自左而右元素非金属性增强,故非金属性F>N,非金属性越强氢化物越稳定,故氢化物的稳定性:HF>NH3,同周期自左而右元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强,故酸性H2SO4>H2SiO3,故答案为:HF>NH3;H2SO4>H2SiO3;
(3)Si与O形成4条共价键,1molSi的最高价氧化物中含有4mol共价键,故答案为:4;
(4)Al与NaOH反应生成偏铝酸钠和氢气,其中水做氧化剂,其反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑ 水;
Ⅱ.常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-,再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,
A为H2O、B为NH3,E为Mg2+或Al3+,A、B、E三种微粒反应的离子方程式为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+,
故答案为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+.
点评:本题考查位置结构性质的关系,推断元素的推断是解题的关键,注意利用短周期的结构及X、W的质子数之和来推断,掌握常见的10电子微粒及其性质是,B溶于A后所得的物质可电离出C和D,是突破口题目难度中等.

练习册系列答案
相关题目
“绿色商品”是指对环境无污染的商品,下列属于“绿色商品”的是( )
| A、含氟冰箱 | B、含铅汽油 |
| C、含磷洗涤剂 | D、含碘食盐 |
 现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.
现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.