题目内容
2.实验探究:催化剂对化学反应速率影响根据所给出的仪器、实验方案回答表格中的问题: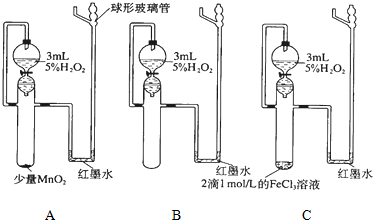
| 实验目的 | 催化剂对过氧化氢分解化学反应速率影响 | ||
| 实验步骤 | 在三个相同的带活塞的漏斗中分别加入2~3mL约5%的H2O2,然后在一支试管中滴加2滴1mol/L的FeCl3溶液,另一支试管中加入少量MnO2固体.同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况. | ||
| 反应条件 | A少量MnO2 | B无催化剂 | C 2滴FeCl3溶液 |
| 实验现象 | |||
| 反应速 率大小 | (用v (A)、v (B)、v (C)表示) | ||
| 得出结论 | |||
分析 双氧水不稳定分解产生氧气,装置中压强增大,红墨水右端上升,反应速率快的,在相同时间内产生氧气多,红墨水上升得高,除有无加入催化剂外,其他条件完全相同,所以通过实验现象对比后可得出催化剂对化学反应速率的影响.
解答 解:双氧水不稳定分解产生氧气,装置中压强增大,红墨水右端上升,反应速率快的,在相同时间内产生氧气多,红墨水上升得高,A加少量MnO2,B无催化剂,C加2滴FeCl3溶液,其他条件是完全相同的,在相同的一段时间内,A中的现象是产生气泡较快,红墨水右端上升;B中产生气泡较慢,红墨水右端上升不明显;C中产生气泡开始慢,然后很快,红墨水右端上升的最高;从而得出这段时间内的平均反应速率的大小关系是:v (C)>v (A)>v (B);这个实验说明了催化剂对反应速率有影响,可以加快化学反应速率,不同催化剂对化学反应速率的催化效果不一样,即催化剂有一定选择性,
故答案为:
| 实验现象 | A中的现象是产生气泡较快,红墨水右端上升. | B中产生气泡较慢,红墨水右端上升不明显. | C中产生气泡开始慢,然后很快,红墨水右端上升的最高. |
| 反应速率大小 | v(C)>v(A)>v(B) | ||
| 得出结论 | 催化剂对反应速率有影响,可以加快化学反应速率,不同催化剂对化学反应速率的催化效果不一样,即催化剂有一定选择性. | ||
点评 本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握对比实验中的控制变量问题,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
18.青蒿酸是合成青蓠素的原科,其可以由香草醛合成:下列叙述正确的是( )
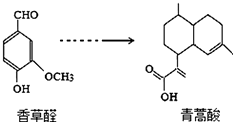

| A. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| B. | 两种物质各1mol分别和氢气反应,最多消耗氢气4mol和3mol | |
| C. | 用FeCl3溶液可鉴别化合物香草醛和青蒿酸 | |
| D. | 青蒿酸分子中含有2个手性碳原子 |
19.非金属性最强的元素在元素周期表的( )
| A. | 左下方 | B. | 右上方 | C. | 右下方 | D. | 左上方 |
16.下列各组物质中,所含化学键类型完全相同的是( )
| A. | HCl和MgCl2 | B. | H2O和CO2 | C. | Ar和CCl4 | D. | NH4Cl和Na2O |
7.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究.草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4═K2SO4+2MnSO4+10CO2↑+8H2O.室温下,实验数据如下:
请回答:
(1)该实验结论是在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用.
(2)还可以控制变量,研究哪些因素对该反应速率的影响:温度、浓度等.
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论.请你写出实验①的现象并分析产生该现象的原因:KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率.
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是酸性KMnO4溶液具有强氧化性,能氧化氯化锰中的氯离子,也会使KMnO4溶液褪色,产生干扰.
| 实验序号 | ① | ② | ③ |
| 加入试剂(取等体积溶液) | 0.01mol/LKMnO4 0.1mol/LH2C2O4 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
(1)该实验结论是在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用.
(2)还可以控制变量,研究哪些因素对该反应速率的影响:温度、浓度等.
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论.请你写出实验①的现象并分析产生该现象的原因:KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率.
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是酸性KMnO4溶液具有强氧化性,能氧化氯化锰中的氯离子,也会使KMnO4溶液褪色,产生干扰.

