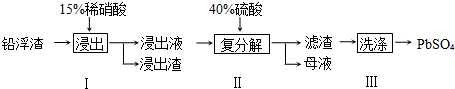
题目内容
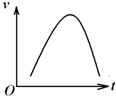 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.(1)写出该反应的离子方程式
(2)反应开始时反应速率加快的原因是
(3)反应后期反应速率减慢的原因是
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-和SO42-,由图可知,反应速率先增大,后减小,开始与氢离子浓度有关,后来与反应物浓度有关,以此来解答.
解答:
解:(1)氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-和SO42-,反应的离子方程式为ClO3-+3HSO3-?Cl-+3H++3SO42-,
故答案为:ClO3-+3HSO3-=Cl-+3SO42-+3H+;
(2)反应开始时反应速率加快,由ClO3-+3HSO3-?Cl-+3H++3SO42-可知,反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故答案为:开始时由于H+浓度逐渐增加,使速率增大;
(3)反应后期反应速率下降,是因随着反应的进行,反应物的浓度减少,反应速率减小,
故答案为:反应后期,由于反应物浓度逐渐下降(减至较小),使反应速率减小.
故答案为:ClO3-+3HSO3-=Cl-+3SO42-+3H+;
(2)反应开始时反应速率加快,由ClO3-+3HSO3-?Cl-+3H++3SO42-可知,反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故答案为:开始时由于H+浓度逐渐增加,使速率增大;
(3)反应后期反应速率下降,是因随着反应的进行,反应物的浓度减少,反应速率减小,
故答案为:反应后期,由于反应物浓度逐渐下降(减至较小),使反应速率减小.
点评:本题考查化学反应速率的影响因素,为高频考点,把握习题中的信息及浓度对反应速率的影响为解答的关键,侧重分析能力及知识应用能力的考查,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、浓硫酸是强电解质,醋酸是弱电解质 |
| B、电解质都能导电,非电解质都不能导电 |
| C、酸性氧化物都是非金属氧化物,碱性氧化物都是金属氧化物 |
| D、氢氧化铁胶体电泳时阴极附近颜色加深 |
某课外小组欲测定过氧化钠与碳酸钠混合物中过氧化钠的质量分数,准确称量a克样品,下列后续实验方案中,不合理的是( )
| A、与足量水反应并加热,收集到标准状况下V1L干燥气体 |
| B、与足量稀盐酸反应并蒸干,称量剩余固体质量m1g |
| C、隔绝空气加热,冷却后,称量剩余固体质量m2g |
| D、溶于足量水,滴入足量氯化钙溶液,过滤、洗涤、干燥、称重质量为m3g |
下列反应类型中,一定没有发生电子转移的是( )
| A、复分解反应 | B、置换反应 |
| C、分解反应 | D、化合反应 |
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、当光束通过鸡蛋清水溶液时,能观察到丁达尔效应 |
| C、水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的 |
| D、Li是最轻的金属,也是活动性强的金属,是制造电池的理想物质 |
某烷烃的结构简式为 ,它的正确命名是( )
,它的正确命名是( )
 ,它的正确命名是( )
,它的正确命名是( )| A、2-甲基-4-乙基戊烷 |
| B、4-甲基-2-乙基戊烷 |
| C、2,4-二甲基己烷 |
| D、3,5-二甲基己烷 |