题目内容
17. 开发新能源和三废处理都是可持续发展的重要方面.
开发新能源和三废处理都是可持续发展的重要方面.(1)H2、CO、CH3OH都是重要能源物质,它们燃烧热依次为285.8KJ/mol、281.5KJ/mol、726.7KJ/mol.已知CO、H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l).则该合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-126.4kJ/mol
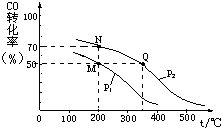
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).在密闭容器中充入10mol CO与20mol H2,CO的平衡转化率与温度、压强的关系如图所示.则M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ;P1<P2(填“>”或“<”或“=”);M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总=5:4.
分析 (1)分别写出CO、H2、CH3OH热化学方程式后,根据盖斯定律就可得出要求的热化学方程式及反应热,分析判断;
(2)化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为70%,参加反应的n(CO)=10mol×70%=7mol,还剩余3molCO,根据方程式知,还剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol,据此计算其物质的量之比.
解答 解:(1)CO燃烧的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-281.5 kJ•mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ•mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.7 kJ•mol-1 ③
将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-126.4KJ•mol-1;故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-126.4kJ/mol;
(2)化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图象知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2;M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为70%,参加反应的n(CO)=10mol×70%=7mol,还剩余3molCO,根据方程式知,还剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol,所以容器中总物质的物质的量之比为:n(M)总:n(N)总=(5+10+5)mol:(3+6+7)mol=5:4;
故答案为:KM=KN>KQ、<、5:4.
点评 本题考查了燃烧热的概念、热化学方程式的书写和盖斯定律、转化率与温度、压强关系,明确温度、压强对该反应平衡影响是解本题关键,题目难度中等.

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 1mol Cl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等 | |
| C. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA | |
| D. | 0.5mol•L-1 Na2SO4溶液中含有的阴、阳离子总数为1.5NA |
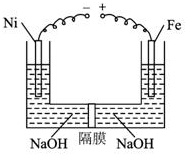 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )| A. | 铅蓄电池是一种二次电池 | |
| B. | 电解时,阳极区溶液的PH不变 | |
| C. | 当阴极收集到0.15mol气体时,可获得0.05molNa2FeO4 | |
| D. | 当阴极收集到0.15mol气体时,铅蓄电池中消耗0.3molH2SO4 |
| A. | 用丙烷和水蒸气高温下反应制取氢气,每产生0.3molCO,同时产生0.7NA个H2分子 | |
| B. | 常温常压下,16 g O3所含的电子数为8NA | |
| C. | 标准状况下 11.2 L NO与11.2 L O2混合,充分反应后所含分子数小于0.75NA | |
| D. | 1 mol/L的Ca(ClO)2溶液中含ClO-数目一定小于2NA |
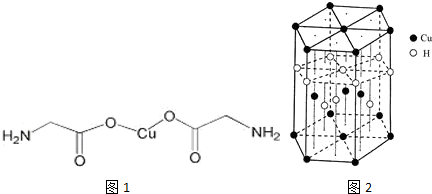
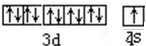 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.
,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.
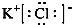 ;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).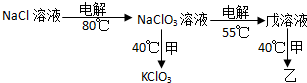
 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.