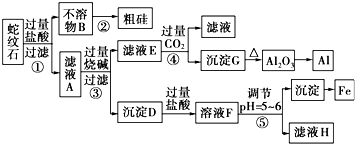
题目内容
7.NaClO2的漂白能力是漂白粉的4~5倍,NaClO2广泛用于造纸工业、污水处理等.工业上生产NaClO2的工艺流程如下:
(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4═2ClO2+2NaHSO4.实际工业生产中,可用硫磺、浓硫酸代替原料中的SO2,其原因为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O(用化学方程式表示).
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:驱赶出ClO2,确保其被充分吸收.
(3)吸收器中生成NaClO2的离子反应方程式为2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O,其中反应温度不能高于5℃的可能原因:提高ClO2的利用率及防止H2O2分解.
(4)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:

①为除去过量的SO2,C中盛放的试剂为NaOH溶液(或KMnO4溶液).
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为2Na2O2+2SO2=2Na2SO3+O2、Na2O2+SO2═Na2SO4.
分析 (1)ClO2发生器中的反应为氯酸钠与二氧化硫在浓硫酸作用下发生氧化还原反应,而硫磺、浓硫酸也可以生成二氧化硫,所以可用硫磺、浓硫酸代替原料中的SO2;
(2)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收;
(3)吸收器中双氧水与ClO2在碱性条件下发生氧化还原反应生成NaClO2,根据电荷守恒和元素守恒可写出离子方程式,为了提高ClO2的利用率及防止H2O2分解,反应温度不能高于高于5℃;
(4)①二氧化硫能被氢氧化钠溶液或高锰酸钾溶液吸收;
②D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,所以B中发生的反应可能为二氧化硫与过氧化钠反应生成亚硫酸钠和氧气.
解答 解:(1)ClO2发生器中的反应为氯酸钠与二氧化硫在浓硫酸作用下发生氧化还原反应,而硫磺、浓硫酸也可以生成二氧化硫,反应的方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O,所以可用硫磺、浓硫酸代替原料中的SO2,
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;
(2)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收,
故答案为:驱赶出ClO2,确保其被充分吸收;
(3)吸收器中双氧水与ClO2在碱性条件下发生氧化还原反应生成NaClO2,反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O,为了提高ClO2的利用率及防止H2O2分解,反应温度不能高于高于5℃,
故答案为:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O;提高ClO2的利用率及防止H2O2分解;
(4)①二氧化硫能被氢氧化钠溶液或高锰酸钾溶液吸收,所以C中盛放的试剂为NaOH溶液(或KMnO4溶液),
故答案为:NaOH溶液(或KMnO4溶液);
②D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,所以B中发生的反应可能为二氧化硫与过氧化钠反应生成亚硫酸钠和氧气,反应的方程式为2Na2O2+2SO2=2Na2SO3+O2,
故答案为:2Na2O2+2SO2=2Na2SO3+O2.
点评 本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊 | 饱和Na2CO3溶液 |
| B | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | 澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度 为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
| 温度 试剂 | T1/℃ | T2/℃ | T2/℃ |
| Ha2CO2 | 23.3 | 20.0 | 23.7 |
| HaCO2 | 18.5 | 20.0 | 20.8 |
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是C
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)
附表:溶解度表
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Ha2CO2 | 12.5g | 21.5g | 39.7g | 40.g |
| HaHCO2 | 8.1g | 9.6g | 11.1g | 12.7 |
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 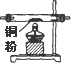 |  |  |  | 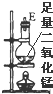 |  |
(1)如果所制得气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)
③接⑤接④接②接①接⑥;其中,②与④装置相连时,玻璃管接口(用装置中字母表示)应是接C.
(2)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(3)实验开始时,应首先检验装置的气密性;实验结束时,应先熄灭①处的酒精灯.
(4)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O
(5)待充分反应后,装置①的玻璃管中呈棕黄色.冷却后,将制得的产物配成溶液,溶液呈绿(或蓝绿)色.
(6)若反应中有71gCl2生成,则被氧化的HCl的物质的量为2mol,转移电子数为2NA.
| A. | 1:3.4 | B. | 1:1.7 | C. | 2.6:1 | D. | 4.6:1 |