题目内容
17.蛇纹石矿可以看做由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如图流程欲分别制得单质Mg、Fe、Al和Si.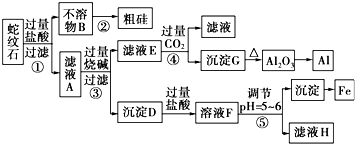
请回答下列问题:
(1)滤液A中含有的阳离子有Mg2+、Al3+、Fe3+、H+.
(2)操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)工业由Al2O3冶炼AI的化学反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2;
(4)写出检验溶液F中主要阳离子的方法:在溶液中滴加KSCN溶液,若出现血红色,则有Fe3+.
分析 蛇纹石矿加盐酸溶解,发生反应的化学方程式为MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,SiO2不与盐酸反应,以固体形式先除去,因此,不溶物B为SiO2,滤液A中除了Mg2+外,还有的金属离子是Al3+和Fe3+、H+,加入过量烧碱,滤液E为偏铝酸钠溶液,通入过量二氧化碳反应生成氢氧化铝沉淀,加热分解生成氧化铝,用电解法冶炼可生成铝;沉淀D为Fe(OH)3和Mg(OH)2,加入过量盐酸生成氯化铁和氯化镁,调节溶液pH=5~6时,促进铁离子水解,生成氢氧化铁沉淀,滤液H为氯化镁溶液,在HCl氛围中加热、蒸发结晶可得MgCl2•6H2O,脱水生成MgCl2,电解可得Mg,据此答题.
解答 解:蛇纹石矿加盐酸溶解,发生反应的化学方程式为MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,SiO2不与盐酸反应,以固体形式先除去,因此,不溶物B为SiO2,滤液A中除了Mg2+外,还有的金属离子是Al3+和Fe3+、H+,加入过量烧碱,滤液E为偏铝酸钠溶液,通入过量二氧化碳反应生成氢氧化铝沉淀,加热分解生成氧化铝,用电解法冶炼可生成铝;沉淀D为Fe(OH)3和Mg(OH)2,加入过量盐酸生成氯化铁和氯化镁,调节溶液pH=5~6时,促进铁离子水解,生成氢氧化铁沉淀,滤液H为氯化镁溶液,在HCl氛围中加热、蒸发结晶可得MgCl2•6H2O,脱水生成MgCl2,电解可得Mg,
(1)根据上面的分析可知,滤液A中除了Mg2+外,还有的金属离子是Al3+和Fe3+、H+,故答案为:Mg2+、Al3+、Fe3+、H+;
(2)滤液A中含有镁离子、铁离子和铝离子,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,偏铝酸根离子和二氧化碳反应生成氢氧化铝和碳酸氢根离子,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)工业上用电解Al2O3的方法冶炼AI,反应的化学反应方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2,故答案为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2;
(4)沉淀D为Fe(OH)3和Mg(OH)2,加入过量盐酸生成氯化铁和氯化镁,所以溶液F中主要含有阳离子为Fe3+ 等,检验Fe3+的方法为:在溶液中滴加KSCN溶液,若出现血红色,则有Fe3+,
故答案为:在溶液中滴加KSCN溶液,若出现血红色,则有Fe3+.
点评 本题考查了实验设计,涉及金属的冶炼、盐类的水解、离子方程式的书写等知识点,易错点是偏铝酸根离子和二氧化碳的反应方程式的书写,注意该反应中水参加反应,难度中等.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案| A. | 在5 min内该反应用C表示的反应速率为0.02 mol•L-1•min-1 | |
| B. | 5 min时,容器内D的浓度为0.2 mol•L-1 | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5 min时容器内气体总的物质的量为3 mol |
| A. | Al3+、AlO2-、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
| A. | 氯化铵和碘都可以用加热法进行提纯 | |
| B. | 铜和氯化钠溶液均能导电 | |
| C. | 硫酸亚铁溶液和氢氧化钠溶液在空气中留置均会变质 | |
| D. | 铁片和铝片置于冷的浓硫酸中均无明显现象 |
| A. | 澄清石灰水中滴加少量的小苏打溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 过氧化钠和水反应:2O22-+2H2O═4OH-+O2↑ | |
| D. | H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5 H2O2+6H+═2Mn2++5O2↑+8H2O |

| A. | C、D是生成物 | B. | 反应的方程式为:2A+B═2C | ||
| C. | 2min后各物质的量不再变化 | D. | 该反应不是可逆反应 |
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式1s22s22p63s1.
(2)B元素在周期表中的位置第3周期第ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是
 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.(4)D-的结构示意图是
 .
.(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O,与D的氢化物的水化物反应的化学方程式为Al(OH)3+3HCl═AlCl3+3H2O.

