题目内容
7.目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等.有关数据见表:| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 沸点/℃ | 3.8 | 11.0 | 82.0 |
(1)常温、常压下,三种氧化物中属于气体的是Cl2O、ClO2.
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为Cl2O7+H2O=2H++2ClO4-.
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有氧化性.
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法
表示出该反应电子转移的方向和数目.
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是AC(填序号).
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为0.1NA.
分析 (1)常温下,沸点低于25℃的为气体;
(2)Cl2O7属于酸性氧化物,与水反应生成HClO4;
(3)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低;
(4)反应2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4中Cl元素由+5价降低到+4价,S元素化合价由+4价升高到+6价,结合化合价的变化解答;
(5)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,存在NaCl中氯元素的化合价未变化;
②根据反应2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl中NaClO3中Cl元素由+5价降低到+4价的ClO2,据此计算.
解答 解:(1)常温下,沸点低于25℃的为气体,则结合表格中的数据可知,Cl2O、ClO2为气体,故答案为:Cl2O、ClO2;
(2)Cl2O7属于酸性氧化物,与水反应生成HClO4,离子方程式为:Cl2O7+H2O=2H++2ClO4-,故答案为:Cl2O7+H2O=2H++2ClO4-;
(3)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低,可说明ClO2具有氧化性,
故答案为:氧化;
(4)反应2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4中Cl元素由+5价降低到+4价,S元素化合价由+4价升高到+6价,转移电子数为2e-,单线桥法
表示出该反应电子转移的方向和数目为 ,
,
故答案为: ;
;
(5)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,HCl作还原剂,同时存在NaCl中氯元素的化合价未变化,故HCl还起酸的作用,
故答案为:AC;
②根据反应2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl中NaClO3中Cl元素由+5价降低到+4价的ClO2,所以产生0.1molClO2,则转移的电子数为0.1NA,
故答案为:0.1NA.
点评 本题考查氧化还原反应、化学计算等,为高频考点,把握物质的性质、发生的反应为解答关键为解答该题的关键,侧重分析与应用能力的考查,注意习题中信息及应用,题目难度不大.

| A. | AgI比AgCl稳定 | B. | 氯的非金属性比碘强 | ||
| C. | I-的还原性比Cl-强 | D. | AgI的溶解度比AgCl小 |
| A. | Na+、H+、SO42-、HCO3- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Cu2+、K+、OH-、NO3- | D. | Ag+、K+、NO3-、Cl-? |
| A. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| B. | 常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>② | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 物质的浓度相同的①氯化铵溶液、②硫酸钠溶液、③碳酸氢钠溶液,pH的顺序为:③>①>② |
①活性炭吸附有色物质 ②氯水漂白有色布条
③过氧化钠露置在空气中 ④将氯气通入水中,溶液呈浅黄绿色
⑤过量过氧化钠加入含酚酞的溶液,溶液先变红后褪色 ⑥利用焰色反应鉴别NaCl和KCl.
| A. | ①②③⑤ | B. | ①②④⑥ | C. | ②③④⑤ | D. | ③④⑤⑥ |
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去Fe(OH)3胶体中的FeCl3 | 过滤 | 分散质粒子的大小不同 |
| B | 除去Na2CO3中的NaHCO3 | 加热 | 稳定性不同 |
| C | 分离KNO3和NaCl | 重结晶 | KNO3的溶解度大于NaCl |
| D | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
| A. | A | B. | B | C. | C | D. | D |
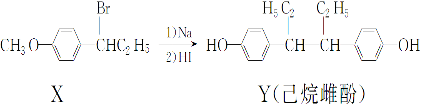
下列叙述正确的是( )
| A. | 在NaOH 水溶液中加热,化合物X 可发生消去反应 | |
| B. | 在一定条件下,化合物Y可与浓溴水发生取代反应 | |
| C. | 用FeCl3溶液不能鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
| A. | A、B元素形成的一系列化合物中,其中A元素质量分数的最大值为25% | |
| B. | 四种元素中电负性最大的是B | |
| C. | C所形成的气态氢化物,在其同主族元素的气态氢化物中沸点最低 | |
| D. | 四种元素中第一电离能最小的是D |
| A. | 蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝 | |
| D. | 向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |