题目内容
16.下列有关实验的叙述正确的是( )| A. | 蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝 | |
| D. | 向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
分析 A.蒸发皿是可以直接加热的仪器,不需要垫上石棉网;
B.萃取剂的密度可以比水小,如苯;
C.氧化铝的熔点较高,包裹在铝表面,导致Al加热熔化但不滴落;
D.由于红褐色能够掩盖白色,无法判断是否含有镁离子.
解答 解:A.蒸发时将蒸发皿放置在铁架台的铁圈上,可以直接加热,不需要加垫石棉网,故A错误;
B.萃取操作时,萃取剂与原溶剂必须互不相溶,萃取剂的密度不一定比水大,如有机溶剂苯的密度小于水,故B错误;
C.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝,故C正确;
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明该溶液中含有Fe2+,由于氢氧化镁白色沉淀易被红褐色掩盖,则无法确定原溶液中是否含有Mg2+,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高考的高频题,题目难度中等,涉及蒸发、萃取、铝、铁及化合物性质等知识,明确常见化学实验基本操作方法为解答关键,注意熟练掌握常见元素及其化合物性质,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
7.目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等.有关数据见表:
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是Cl2O、ClO2.
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为Cl2O7+H2O=2H++2ClO4-.
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有氧化性.
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法
表示出该反应电子转移的方向和数目.
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是AC(填序号).
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为0.1NA.
| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 沸点/℃ | 3.8 | 11.0 | 82.0 |
(1)常温、常压下,三种氧化物中属于气体的是Cl2O、ClO2.
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为Cl2O7+H2O=2H++2ClO4-.
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有氧化性.
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法
表示出该反应电子转移的方向和数目.
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是AC(填序号).
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为0.1NA.
7.海藻中含丰富的、以离子形式存在的碘元素.如图是实验室从海藻里提取碘的流程的一部分下列判断正确的是( )


| A. | 步骤①、③的操作都是过滤 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是乙醇 | |
| D. | 步骤④的操作是精馏 |
1.下列试验中,所选装置不合理的是( )
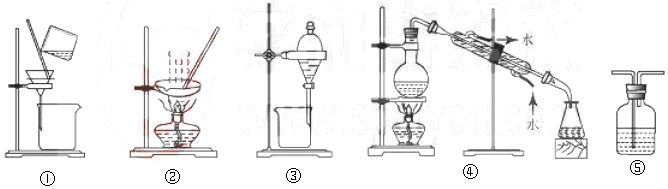

| A. | 粗盐提纯,选①和② | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 用NaOH溶液吸收少量C12选⑤ | D. | 分离Na2CO3溶液和CH3COOC2H5,选④ |
8.X(g)+3Y(g)?2Z(g)△H=-a kJ•mol-1,一定条件下,将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.下列说法正确的是( )
| A. | 10 min内,Y的平均反应速率为0.03 mol•L-1•s-1 | |
| B. | 10 min内,X和Y反应放出的热量为a kJ | |
| C. | 10 min内,消耗0.2 mol X,生成0.4 mol Z | |
| D. | 10 min内,前5minX的平均反应速率与后5minX的平均反应速率相同 |
5.已知同温同压下,下列反应的焓变和平衡常数分别表示为
(1)2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1 K1=a
(2)2NO(g)+O2(g)?2NO2(g)△H2=-144kJ•mol-1 K2=b
(3)NO2(g)+SO2(g)?SO3(g)+NO(g)△H3=-m kJ•mol-1 K3=c
下列说法正确的是( )
(1)2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1 K1=a
(2)2NO(g)+O2(g)?2NO2(g)△H2=-144kJ•mol-1 K2=b
(3)NO2(g)+SO2(g)?SO3(g)+NO(g)△H3=-m kJ•mol-1 K3=c
下列说法正确的是( )
| A. | m=53 c2=a/b | B. | m=-26.5 2c=a-b | C. | m=-170.5 2c=a-b | D. | m=26.5 c2=$\frac{a}{b}$ |
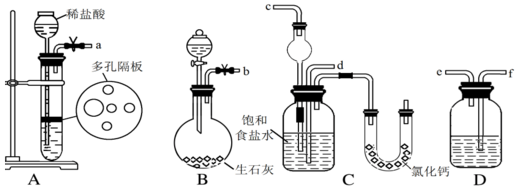

 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$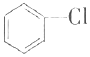 +HCl
+HCl