��Ŀ����
ijУ��ѧ�о���ѧϰС���ͬѧ��ѧϰ�˰����������ۣ�������ȵ�˼�룬��Ȼ�������л�ԭ�ԣ��ܷ���H2������ԭCuO�أ��������ʵ����ȡ������̽���������⣮��������С��Ļ����������о���
��һ����ȡ����
��1��д��ʵ����ȡ�����Ļ�ѧ����ʽ
��2����ʵ�����У���������Ũ��ˮ�� ����дһ���Լ���������ȡ����������
��������С����ijͬѧ�����������ʾ��ʵ��װ�ã��гּ�β������װ��δ��������̽�������Ļ�ԭ�ԣ�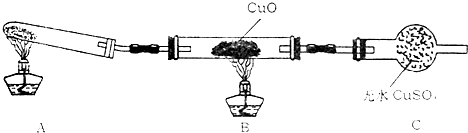
��1����װ�����������һ��ȱ�ݣ�Ϊ��֤ʵ������ȷ�ԣ��Ը�װ�õĸĽ���ʩ��
��2�����øĽ����װ�ý���ʵ�飬�۲쵽CuO��Ϊ��ɫ���ʣ���ˮCuSO4����ɫ��ͬʱ����һ������Ⱦ�����壮д��������CuO��Ӧ�Ļ�ѧ����ʽ
��������������
��1����ͬѧ��Ϊ��NH3��CuO��Ӧ���ɵĺ�ɫ�����п��ܺ���Cu2O����֪��Cu2O���ּ����������������Һ�У�Cu+���ȶ��Ա�Cu2+��
��Cu+
Cu+Cu2+�����������һ����ʵ�����ú�ɫ�������Ƿ���Cu2O�� ��
��2���ڽ�������⣨1��������ͬѧ�����Cu2O��CuO�����ȶ����ĸ���ǿ���������ǽ���������ʵ�飺ȡ98g Cu��OH��2���壬������80�桫100��ʱ���õ���ɫ�����ĩ���������ȵ�1000�����ϣ���ɫ��ĩȫ����Ϊ��ɫ��ĩA����ȴ�������A������Ϊ72g���ݴ˿��Ƶã�A�Ļ�ѧʽΪ ���ɴˣ��õ��Ľ�����
��
��һ����ȡ����
��1��д��ʵ����ȡ�����Ļ�ѧ����ʽ
��2����ʵ�����У���������Ũ��ˮ��
��������С����ijͬѧ�����������ʾ��ʵ��װ�ã��гּ�β������װ��δ��������̽�������Ļ�ԭ�ԣ�

��1����װ�����������һ��ȱ�ݣ�Ϊ��֤ʵ������ȷ�ԣ��Ը�װ�õĸĽ���ʩ��
��2�����øĽ����װ�ý���ʵ�飬�۲쵽CuO��Ϊ��ɫ���ʣ���ˮCuSO4����ɫ��ͬʱ����һ������Ⱦ�����壮д��������CuO��Ӧ�Ļ�ѧ����ʽ
��������������
��1����ͬѧ��Ϊ��NH3��CuO��Ӧ���ɵĺ�ɫ�����п��ܺ���Cu2O����֪��Cu2O���ּ����������������Һ�У�Cu+���ȶ��Ա�Cu2+��
��Cu+
| H+ |
��2���ڽ�������⣨1��������ͬѧ�����Cu2O��CuO�����ȶ����ĸ���ǿ���������ǽ���������ʵ�飺ȡ98g Cu��OH��2���壬������80�桫100��ʱ���õ���ɫ�����ĩ���������ȵ�1000�����ϣ���ɫ��ĩȫ����Ϊ��ɫ��ĩA����ȴ�������A������Ϊ72g���ݴ˿��Ƶã�A�Ļ�ѧʽΪ
���㣺������ȡ������
ר�⣺����Ԫ��
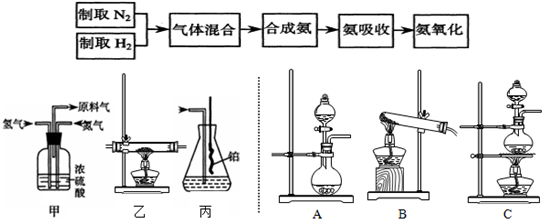
��������һ����1��ʵ�����ù����Ȼ�狀���ʯ�ҷ�ĩ��ϼ�����ȡ������
��2����Ũ��ˮ��NaOH�������ʯ�һ��ʯ�ҵȻ�Ͽ���Ѹ���Ʊ�����������
��������1���Ȼ�狀���ʯ�ҷ�Ӧ���ɰ�����ˮ��������CuO��ӦǰӦ�ȸ��
��2���������֪������Ϊͭ��������ˮ���Դ���д��ѧ����ʽ��
��������1������Cu2O�����������²��ȶ������ʷ�����
��2��������ɫ�仯�ж��ڲ�ͬ�¶��µIJ�������ж��ȶ��ԣ�
��2����Ũ��ˮ��NaOH�������ʯ�һ��ʯ�ҵȻ�Ͽ���Ѹ���Ʊ�����������
��������1���Ȼ�狀���ʯ�ҷ�Ӧ���ɰ�����ˮ��������CuO��ӦǰӦ�ȸ��
��2���������֪������Ϊͭ��������ˮ���Դ���д��ѧ����ʽ��
��������1������Cu2O�����������²��ȶ������ʷ�����
��2��������ɫ�仯�ж��ڲ�ͬ�¶��µIJ�������ж��ȶ��ԣ�
���
�⣺��һ����1��ʵ�������Ȼ�狀���ʯ�ҷ�Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ2NH4Cl+Ca��OH��2
CaCl2+2NH3��+2H2O��
�ʴ�Ϊ��2NH4Cl+Ca��OH��2
CaCl2+2NH3��+2H2O��
��2����Ũ��ˮ��NaOH�������ʯ�һ��ʯ�ҵȻ�Ͽ���Ѹ���Ʊ������������ʴ�Ϊ��NaOH�������ʯ�һ��ʯ�ҵȣ�
��������1���Ȼ�狀���ʯ�ҷ�Ӧ���ɰ�����ˮ��������CuO��ӦǰӦ�ȸ���ʴ�Ϊ����װ��A��B֮������װ�м�ʯ�ҵĸ���ܣ�
��2��CuO��Ϊ��ɫ���ʣ���ˮCuSO4����ɫ��ͬʱ����һ������Ⱦ�����壬˵������ͭ��������ˮ����Ӧ�Ļ�ѧ����ʽΪ3CuO+2NH3
3Cu+N2+3H2O��
�ʴ�Ϊ��3CuO+2NH3
3Cu+N2+3H2O��
��������1����������Ϣ��֪��Cu2O��һ�ּ����������������Һ�У�Cu+���ȶ��Ա�Cu2+�2Cu+=Cu+Cu2+������Cu2O���������з�����Cu2O+H2SO4=CuSO4+Cu+H2O���ɹ۲쵽��Һ������ɫ��˵����ɫ�����к���Cu2O����֮��û�У��ʴ�Ϊ��ȡ������Ʒ������ϡ���ᣬ����Һ������ɫ��˵����ɫ�����к���Cu2O����֮��û�У�
��2��ȡ98g Cu��OH��2���壬��n�� Cu��OH��2��=1mol��������80�桫100��ʱ���õ���ɫ�����ĩ���ú�ɫ��ĩΪCuO���������ȵ�1000�����ϣ���ɫ��ĩȫ����Ϊ��ɫ��ĩA����AΪCu2O�����ݷ�Ӧ2Cu��OH��2
Cu2O+2H2O����ɵ�m��Cu2O��=n��Cu2O����M��Cu2O��=0.5mol��144g/mol=72g��˵����ɫ��ĩΪCu2O����Cu2O��CuO�ȶ����ʴ�Ϊ��Cu2O��CuO��Cu2O�����ȶ��Բ
| ||
�ʴ�Ϊ��2NH4Cl+Ca��OH��2
| ||
��2����Ũ��ˮ��NaOH�������ʯ�һ��ʯ�ҵȻ�Ͽ���Ѹ���Ʊ������������ʴ�Ϊ��NaOH�������ʯ�һ��ʯ�ҵȣ�
��������1���Ȼ�狀���ʯ�ҷ�Ӧ���ɰ�����ˮ��������CuO��ӦǰӦ�ȸ���ʴ�Ϊ����װ��A��B֮������װ�м�ʯ�ҵĸ���ܣ�
��2��CuO��Ϊ��ɫ���ʣ���ˮCuSO4����ɫ��ͬʱ����һ������Ⱦ�����壬˵������ͭ��������ˮ����Ӧ�Ļ�ѧ����ʽΪ3CuO+2NH3
| ||
�ʴ�Ϊ��3CuO+2NH3
| ||
��������1����������Ϣ��֪��Cu2O��һ�ּ����������������Һ�У�Cu+���ȶ��Ա�Cu2+�2Cu+=Cu+Cu2+������Cu2O���������з�����Cu2O+H2SO4=CuSO4+Cu+H2O���ɹ۲쵽��Һ������ɫ��˵����ɫ�����к���Cu2O����֮��û�У��ʴ�Ϊ��ȡ������Ʒ������ϡ���ᣬ����Һ������ɫ��˵����ɫ�����к���Cu2O����֮��û�У�
��2��ȡ98g Cu��OH��2���壬��n�� Cu��OH��2��=1mol��������80�桫100��ʱ���õ���ɫ�����ĩ���ú�ɫ��ĩΪCuO���������ȵ�1000�����ϣ���ɫ��ĩȫ����Ϊ��ɫ��ĩA����AΪCu2O�����ݷ�Ӧ2Cu��OH��2
| ||
���������⿼��ͭ�Ļ����������̽������Ŀ�Ѷ��еȣ������������ʺ�ʵ����������ǽ���ؼ���

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
����˵����ȷ���ǣ�������
| A������ԭ��ʧ����Խ�࣬�仹ԭ��Խǿ |
| B��CH4��Ħ������Ϊ16g |
| C��10g��������Ϊ98%��H2SO4����ˮϡ����100g��H2SO4����������Ϊ9.8% |
| D����������ʱ���һ������ |



 ʵ������ȡ������������ͼװ�ã�
ʵ������ȡ������������ͼװ�ã�