题目内容
设NA为阿伏加德罗常数.下列说法中正确的是( )
| A、1molNH4+中含有10NA个质子 |
| B、t℃时,1LpH=6的纯水中,含1×10-6 NA个OH- |
| C、78gNa2O2中含阴离子的数目为2 NA |
| D、向FeI2溶液中通入适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据1mol铵离子含有11mol质子分析;
B、根据纯水中氢离子的物质的量等于氢氧根离子的物质的量分析;
C、根据过氧化钠中的阴离子为过氧根离子分析;
D、根据碘离子和亚铁离子都能够被氯气氧化且先氧化碘离子再氧化亚铁离子分析.
B、根据纯水中氢离子的物质的量等于氢氧根离子的物质的量分析;
C、根据过氧化钠中的阴离子为过氧根离子分析;
D、根据碘离子和亚铁离子都能够被氯气氧化且先氧化碘离子再氧化亚铁离子分析.
解答:
解:A、1mol铵离子中含有11mol质子,含有11NA个质子,故A错误;
B、纯水中氢离子物质的量等于氢氧根离子物质的量,pH=6纯水中,氢离子浓度为10-6mol/L,1L纯水中含有氢离子的物质的量为10-6mol,含有的氢氧根离子的物质的量也是10-6mol,即10-6NA个OH-,故B正确;
C、78g过氧化钠的物质的量为1mol,含有1mol过氧根离子,含阴离子的数目为NA,故C错误;
D、FeI2溶液中,碘离子的还原性大于亚铁离子的,通入适量氯气,当有1molFe2+被氧化时,溶液中碘离子已经完全被氧化,由于不知道碘化亚铁的物质的量,无法计算转移的电子数,故D错误;
故选B.
B、纯水中氢离子物质的量等于氢氧根离子物质的量,pH=6纯水中,氢离子浓度为10-6mol/L,1L纯水中含有氢离子的物质的量为10-6mol,含有的氢氧根离子的物质的量也是10-6mol,即10-6NA个OH-,故B正确;
C、78g过氧化钠的物质的量为1mol,含有1mol过氧根离子,含阴离子的数目为NA,故C错误;
D、FeI2溶液中,碘离子的还原性大于亚铁离子的,通入适量氯气,当有1molFe2+被氧化时,溶液中碘离子已经完全被氧化,由于不知道碘化亚铁的物质的量,无法计算转移的电子数,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数,注意碘化亚铁中,碘离子的还原性大于亚铁离子的,通入氯气,先氧化碘离子再氧化亚铁离子,本题难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
甲醛、乙醛、丙醛组成的混合物中氢元素的质量分数为9%,则氧元素的质量分数是( )
| A、16.5% | B、37% |
| C、48% | D、无法计算 |
设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A、0.1mo1?L-1MgCl2溶液中含Cl-数为0.2 NA |
| B、1 L 0.1m01?L-1AlCl3溶液中,Al3+数为0.1NA |
| C、标准状况下,22.4L的CCl4中含CCl4分子数为NA |
| D、1mol铁与足量的Cl2反应,转移的电子数为3NA |
某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
| A、Cl-、Mg2+、H+、Cu2+、SO42- |
| B、Na+、Ba2+、NO3-、OH-、SO42- |
| C、MnO4-、K+、Cl-、H+、SO42- |
| D、K+、NO3-、SO42-、OH-、Na+ |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、100 mL 1mol?L-1AlCl3溶液中含阳离子数为0.1NA |
| B、标准状况下,1L液态水中含有的10-7NA个H+ |
| C、一定温度下,1L0.5 mol?L-1NH4C1溶液有aNA个NH4+,2L0.25 mol?L-1NH4Cl溶液有bNA个NH4+,则a>b |
| D、2mol SO2和1 mol O2混合在盛有V2O5的密闭容器中加热反应后,容器内物质分子数等于2NA |
用NA表示阿伏加德罗常数,下列说法中一定正确的是( )
| A、1 mol甲烷中的氢原子被氯原子完全取代,需要2NA Cl2 | ||
B、常温常压下,mg乙烯与mg丙烯中均含有(
| ||
| C、标准状况下,22.4 L Br2中所含的分子数为NA | ||
| D、1 mol?L -1 Mg(NO3)2溶液中含有NO3-的数目为2NA |
下列各组离子在溶液中既可以大量共存,且加入氨水后,也不产生沉淀的是( )
| A、Na+、Mg2+、Cl-、HCO3- |
| B、H+、NH4+、Al3+、SO42- |
| C、H+、Cl-、CH3COO-、NO3- |
| D、K+、AlO2-、NO3-、OH- |
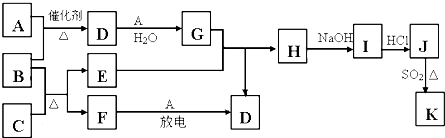
 A~H是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知B、D是生活中常见的金属单质,G是气体单质,C的焰色反应呈黄色.
A~H是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知B、D是生活中常见的金属单质,G是气体单质,C的焰色反应呈黄色.