题目内容
18.如图,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )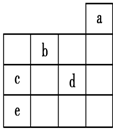
| A. | 元素b位于VIA族,有+6、-2两种常见化合价 | |
| B. | 元素的最高价氧化物对应的水化物的酸性:d>c>e | |
| C. | 金属性c>e | |
| D. | 元素的气态氢化物的稳定性:e>c>d |
分析 由元素在周期表中位置可知,a为He、b为O、c为P、d为Cl、e为As.
A.氧元素除0价外,还有-1、-2等化合价;
B.非金属性越强,最高价氧化物对应的水化物的酸性越强;
C.同主族从上到下金属性增强;
D.非金属性越强,对应氢化物越稳定.
解答 解:由元素在周期表中位置可知,a为He、b为O、c为P、d为Cl、e为As.
A.氧元素除0价外,还有-1、-2等化合价,O元素无正价,故A错误;
B.非金属性d>c>e,最高价氧化物对应的水化物的酸性为d>c>e,故B正确;
C.同主族从上到下金属性增强,金属性c<e,故C错误;
D.非金属性d>c>e,对应氢化物的稳定性为d>c>e,故D错误;
故选B.
点评 本题考查位置、结构与性质的综合应用,为高频考点,把握元素的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
8.对Na、Mg、Al的有关性质的叙述错误的是( )
| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:Na<Mg<Al | D. | 还原性:Na>Mg>Al |
6.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.3g钠与水反应失去的电子数目为0.2NA | |
| B. | 20℃、101KPa时,5.6L NH3 所含的原子数目为NA | |
| C. | 10℃、101KPa时,16g CH4 所含有的电子数为10NA | |
| D. | 1mol NaCl固体溶于1L水所得的溶液中NaCl的物质的量浓度为1 mol•L-1 |
13.向溶液X中持续通入气体Y,会产生“浑浊→澄清”现象的是( )
| A. | X:氯化铝溶液,Y:氨气 | |
| B. | X:硅酸钠溶液,Y:二氧化硫 | |
| C. | X:氢氧化钡溶液,Y:一氧化碳 | |
| D. | X:四羟基合铝酸钠溶液,Y:二氧化氮 |
3.下列说法正确的是( )
| A. | 甘油(CH2OH-CHOH-CH2OH)分子中含有1个手性碳原子 | |
| B. | 互为手性异构体的化合物,所含化学键的种类和数目完全相同 | |
| C. | 互为手性异构体的化合物,在三维空间不能重合,但物理、化学性质却几乎完全相同 | |
| D. | 互为手性异构体的化合物,分子组成不同,所以物理、化学性质也不同 |
10.用布氏漏斗和吸滤瓶接抽水泵过滤沉淀后,正确的操作是( )
| A. | 先关水龙头,拔下抽滤瓶上的橡皮管,再取下布氏漏斗 | |
| B. | 先取下布氏漏斗,再关上水龙头 | |
| C. | 先将沉淀和滤纸一起取出,再关上水龙头 | |
| D. | 先拔下抽滤瓶上的橡皮管,关上水龙头,再取下布氏漏斗 |
8.不同元素的原子电负性不同,若用x值来表示,x值越大,其原子的电负性就越大,吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短周期元素的电负性的值:
(1)通过分析x值的变化规律,确定N、Mg的x值的范围:0.93<x(Mg)<1.57,2.55<x(N)<3.44.
(2)推测x值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.根据短周期元素x值变化特点,体现了元素性质的周期性变化规律.
(3)某有机物结构简式如图,其中C-N中,你认为共用电子对偏向氮原子(填原子名称).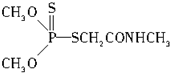
(4)经验规律告诉我们,当成键的两原子的x差值,即△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键的类型为共价键
(5)预测元素周期表中x值最小的元素是Cs(填元素符号,放射性元素除外).
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 第二周期 | Li | Be | B | C | N | O | F |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | |
| 第三周期 | Na | Mg | Al | Si | P | S | Cl |
| 电负性值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)推测x值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.根据短周期元素x值变化特点,体现了元素性质的周期性变化规律.
(3)某有机物结构简式如图,其中C-N中,你认为共用电子对偏向氮原子(填原子名称).
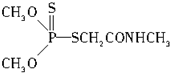
(4)经验规律告诉我们,当成键的两原子的x差值,即△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键的类型为共价键
(5)预测元素周期表中x值最小的元素是Cs(填元素符号,放射性元素除外).