题目内容
13.一定温度下,加水稀释0.1mol/L氨水,下列有关说法错误的是( )| A. | 溶液的pH减小 | B. | 溶液中所有离子的浓度减小 | ||
| C. | 氨水的电离程度变大 | D. | 氨水的电离平衡常数Kb不变 |
分析 加水稀释0.1mol/L氨水,促进一水合氨的电离,氢氧根离子的物质的量增大,但浓度减小,Kb只与温度有关,以此来解答.
解答 解:A.稀释时,氢氧根离子浓度减小,pH减小,故A正确;
B.氧根离子浓度减小,Kw不变,则氢离子浓度增大,故B错误;
C.加水促进电离,氨水的电离程度变大,故C正确;
D.Kb只与温度有关,则稀释时氨水的电离平衡常数Kb不变,故D正确;
故选B.
点评 本题考查弱电解质的电离,为高频考点,把握电离平衡移动、Kw与Kb与温度的关系为解答的关键,侧重分析与应用能力的考查,注意氢氧根离子的物质的量与浓度变化,题目难度不大.

练习册系列答案
相关题目
4.一定温度下,将0.1molAgCl加入1L 0.1mol•L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是( )
| A. | 相同温度下,AgCl的溶解性比Ag2CO3强 | |
| B. | 沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol•L-1 | |
| C. | 混合后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c(H+) | |
| D. | 混合后溶液中的:c(Na+)+c(H+)+c(Ag+)=2 c(CO32-)+c(HCO3-)+c(OH-) |
1.某有机物键线式的结构为  ,关于其说法正确的是( )
,关于其说法正确的是( )
 ,关于其说法正确的是( )
,关于其说法正确的是( )| A. | 分子式为C8H10O2 | |
| B. | 可发生氧化、取代、加成反应 | |
| C. | 该有机物的含酯基的芳香族化合物的同分异构体有4种 | |
| D. | 它的另一种同分异构体 最多有13个原子共平面 最多有13个原子共平面 |
8.25℃时,将2.3g钠投入到500g水中充分反应,加水配成1000mL溶液,则该溶液的pH为( )
| A. | 1 | B. | 8 | C. | 12 | D. | 13 |
18.在下列各组溶液中,离子一定能大量共存的是( )
| A. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- | |
| B. | NaHCO3溶液中:Na+、K+、SO42-、AlO2- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol/L的溶液:Na+、K+、AlO2-、CO32- |
5.鉴别固体Na2CO3和NaHCO3的最好方法是( )
| A. | 分别与同浓度的稀盐酸反应 | B. | 分别加入NaOH溶液 | ||
| C. | 分别加入石灰水 | D. | 溶于水,比较其溶解性 |
2.下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A. | Na2O2与H2O反应 | B. | 灼热的木炭与水蒸气反应 | ||
| C. | 铝热反应 | D. | CH4与O2反应 |
17.金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示.下列说法正确的是( )
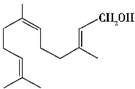

| A. | 金合欢醇与乙醇是同系物 | |
| B. | 金合欢醇可发生加成反应,但不能发生取代反应 | |
| C. | 1 mol 金合欢醇能与3 mol H2 反应,也能与3 mol Br2反应 | |
| D. | 1 mol 金合欢醇与足量Na 反应生成1mol 氢气,完全燃烧时消耗O2 21 mol |
 如图所示,A处通气体,B处加热一段时间后,停止加热,观察现象:
如图所示,A处通气体,B处加热一段时间后,停止加热,观察现象: