题目内容
15.设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )| A. | 0.5 mol锌粒与足量盐酸反应产生11.2 L H2 | |
| B. | 标准状况下,18g的H2O中含有的电子数为10NA | |
| C. | 常温常压下,11.2L氧气所含的原子数为NA | |
| D. | 2.4g金属镁变为镁离子失去的电子数为0.1NA |
分析 A.气体状况未知,无法计算气体的体积;
B.质量转化为物质的量结合1个水分子含有10个电子解答;
C.常温常压,Vm≠22.4L/mol;
D.1个镁原子失去2个电子生成+2价镁离子.
解答 解:A.气体状况未知,气体摩尔体积不确定,无法计算气体的体积,故A错误;
B.18g水的物质的量为:$\frac{18g}{18g/mol}$=1mol,含有电子数为10NA,故B正确;
C.常温常压,Vm≠22.4L/mol,无法计算氧气的物质的量,故C错误;
D.2.4g金属镁物质的量为$\frac{2.4g}{24g/mol}$=0.1mol,失去的电子数为0.2NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积使用条件和对象是解题关键,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
5.有四位同学分别对四种溶液中所含的离子进行检测,所得结果如下,其中所得结果错误的是( )
| A. | Mg+、Na+、Cl-、NO3- | B. | Na+、NO3-、OH-、HCO3- | ||
| C. | OH-、CO32-、Cl-、K+ | D. | Ba2+、Na+、OH-、NO3- |
6.有机物M是苯的同系物,其结构为 ,则M可能的结构简式共有( )
,则M可能的结构简式共有( )
 ,则M可能的结构简式共有( )
,则M可能的结构简式共有( )| A. | 6种 | B. | 12种 | C. | 24种 | D. | 32种 |
3.物质的量浓度都是0.1mol/L的下列溶液,酸性最强的是( )
| A. | HCl | B. | H2SO4 | C. | CH3COOH | D. | ( NH4)2SO4 |
20.下列说法不正确的是( )
| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | SO2使溴水褪色,不能说明SO2具有漂白性 | |
| C. | HCl、NO2溶于水都有化学键断裂,但不全属于化学变化 | |
| D. | 为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液 |
7.下列描述的正确的是( )
| A. | Na2O2与水反应是水作还原剂的氧化还原反应 | |
| B. | 过氧化钠的电子式为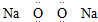 | |
| C. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA | |
| D. | 二氧化碳通过Na2O2粉末,反应后固体物质增重 |
4.下列行为中符合安全要求的是( )
| A. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,将水倒入浓硫酸中配制稀硫酸 | |
| D. | 进入煤矿井时,用火把照明 |
5.某有机物链状分子中含n个-CH2-,m个 ,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
 ,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )| A. | m+n+a | B. | m+2-a | C. | 2n+3m-a | D. | m+2n+2-a |