题目内容
13.设NA为阿伏加德罗常数,下列叙述中正确的是( )| A. | 1.7 g氨气所含分子数为0.1 NA | |
| B. | 常温常压下,11.2 L氯气所含原子数为NA | |
| C. | 1 mol•L-1的BaCl2溶液中所含Cl-离子数目为2 NA | |
| D. | 71 g氯气与足量铁粉充分反应,转移的电子数为3 NA |
分析 A、求出氨气的物质的量,然后根据分子个数N=nNA来分析;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、溶液体积不明确;
D、求出氯气的物质的量,然后根据氯气和铁反应后变为-1价来分析.
解答 解:A、1.7g氨气的物质的量为0.1mol,故分子个数N=nNA=0.1NA个,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氯气的物质的量小于0.5mol,则含有的原子个数小于NA个,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、71g氯气的物质的量为1mol,而氯气和铁反应后变为-1价,故1mol氯气反应后转移2NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.

练习册系列答案
相关题目
3.关于SO2性质和现象的对应描述,正确的是( )
| A. | SO2具有氧化性,能使品红溶液褪色 | |
| B. | SO2具有漂白性,能使溴水褪色 | |
| C. | SO2具有还原性,能与Ba(NO3)2溶液反应生成沉淀 | |
| D. | SO2具有漂白性,能使滴加酚酞的NaOH溶液由红色变为无色 |
4. 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: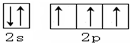 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)N>O>C.
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)H2O,原因是水分子间可以形成氢键,使沸点升高.
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:C≡O.
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2OD.[R(H2O)3Cl3]•3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续滴加氨水至过量,沉淀溶解,
得到天蓝色溶液,写反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 地壳中含量最多的元素 |
| Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | N能层上只有一个电子,K、L、M层均排满电子 |
(1)写出元素Y的原子核外价电子排布图:
 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)N>O>C.
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)H2O,原因是水分子间可以形成氢键,使沸点升高.
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:C≡O.
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2OD.[R(H2O)3Cl3]•3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续滴加氨水至过量,沉淀溶解,
得到天蓝色溶液,写反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
1.五种短周期元素在元素周期表中的位置如表所示,其中X元素最高正化合价与最低负化合价的代数和为0,下列判断不正确的是( )
| X | |||||
| Z | Y | M | N |
| A. | N的氧化物对应水化物的酸性一定比X的氧化物对应水化物的酸性强 | |
| B. | 相同条件下,与同浓度、同体积的盐酸反应,单质Z的反应速率大于单质Y | |
| C. | X的原子半径比Y的小 | |
| D. | X和M的原子序数相差10 |
8.下列分类标准和分类结果不对应的是( )
| 选项 | 分类标准 | 分类结果 |
| A | 根据化学反应中有无单质参加或生成 | 氧化还原反应和非氧化还原反应 |
| B | 根据化学反应中有无离子参加或生成 | 离子反应和非离子反应 |
| C | 根据混合物中分散质粒子直径的大小 | 胶体、溶液和浊液 |
| D | 根据无机化合物的组成和性质特点 | 酸、碱、盐、氧化物等 |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法不正确的是( )
| A. | 核素23Na的中子数是12 | |
| B. | 16O和18O互为同位素 | |
| C. | 电离方程式:CH3COOH?CH3COOˉ+H+ | |
| D. | 16O、1H、2H、3H四种核素可构成4种水分子 |
2.图所示的实验装置图正确且能达到相应实验目的是( )
| A. |  用图所示装置除去Cl2中的HCl | |
| B. |  用图所示装置实验室制NH3 | |
| C. |  用图所示装置分离MnO2和KCl | |
| D. |  用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
11.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂 | |
| B. | 明矾在水中能形成胶体,可作为净水剂 | |
| C. | 氢氟酸具有弱酸性,可用氢氟酸雕刻玻璃 | |
| D. | 过氧化钠具有强氧化性,可用作潜水艇中氧气的来源 |
