题目内容
6.下列各式中,属于正确的电离方程式的是( )| A. | HCO3-+H2O?H2CO3+OH- | B. | HS-+H2O?S2-+H3O- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43+ |
分析 A.碳酸氢根离子水解生成碳酸和氢氧根离子;
B.水合氢离子H3O-书写错误;
C.碳酸氢根离子电离出氢离子和碳酸根离子;
D.多元弱酸应分步电离.
解答 解:A.HCO3-+H2O?H2CO3+OH-碳酸氢根离子水解生成碳酸和氢氧根离子,属于水解反应,电离方程式为:HCO3-?H++CO32-或HCO3-+H2O?H3O++CO32-,故A错误;
B.HS-电离方程式为:HS-+H2O?S2-+H3O+,故B错误;
C.碳酸氢根离子部分电离,电离方程式:HCO3-+H2O?H3O++CO32-或HCO3-?H++CO32-,故C正确;
D.H3PO4?H++H2PO4-,H2PO4-?H++HPO42-,HPO42-?H++PO43-,故D错误;
故选C.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
16.下列有关化学反应速率和限度的说法中,正确的是( )
| A. | 水的生成与水的电解是可逆反应 | |
| B. | 实验室用H2O2制O2,加入MnO2后,反应速率明显加快 | |
| C. | 反应2SO2+O2═2SO3中,可以通过改变反应条件让SO2、O2完全转化为SO3 | |
| D. | 金属钠与足量水反应,增加水的量能加快反应速率 |
17.关于下列有机物性质的说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
11.10℃加热NaHCO3饱和溶液,测得该溶液的pH发生如下的变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该水解反应的离子方程式为HCO3-+H2O?H2CO3+OH-.
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3,该分解反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生沉淀,则乙判断正确.原因是加入氯化钡溶液后,如生成沉淀,说明溶液中存在大量的CO32-,Ba2++CO32-=BaCO3↓.
能不能选用Ba(OH)2溶液?不能(答“能”或“不能”)
②将加热后的溶液冷却到10℃,若溶液的pH等于(填“大于”、“小于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| PH | 8.3 | 8.4 | 8.5 | 8.8 |
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3,该分解反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生沉淀,则乙判断正确.原因是加入氯化钡溶液后,如生成沉淀,说明溶液中存在大量的CO32-,Ba2++CO32-=BaCO3↓.
能不能选用Ba(OH)2溶液?不能(答“能”或“不能”)
②将加热后的溶液冷却到10℃,若溶液的pH等于(填“大于”、“小于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
15.氢气和氮气一定条件下反应生成氨气.已知 H-H 键、N≡N、H-N 键能分别为为Q1、Q2、Q3kJ•mol-1.下列关系式中正确的是( )
| A. | 3Q1+3Q2<2Q3 | B. | Q1+Q2<Q3 | C. | 3Q1+Q2<6Q3 | D. | 3Q1+Q2<2Q3 |

 、B
、B .
. +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$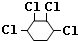 .
.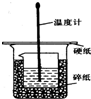 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题: