题目内容
13.有机化合物P(C8H9NO2)可用如下方法来合成: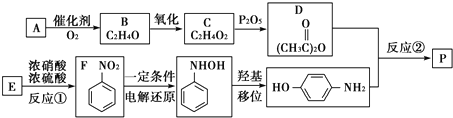
已知:受对位取代基的影响,HO-
 -NH2中-NH2上的氢原子较活泼.
-NH2中-NH2上的氢原子较活泼.请回答下列问题:
(1)若A分子的核磁共振氢谱只有一个吸收峰且能使溴水褪色,则其结构简式为CH2═CH2.
(2)写出C→D的化学方程式:2CH3COOH→(CH3CO)2O+H2O.
(3)反应②的反应类型为取代反应;写出P在氢氧化钠溶液中发生水解反应的化学方程式:
 .
.(4)有机物W的结构简式为
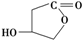 ,W的酸性水解产物的名称为3,4-二羟基丁酸;W不具有的化学性质中是C(填代号).
,W的酸性水解产物的名称为3,4-二羟基丁酸;W不具有的化学性质中是C(填代号).A.与浓HBr溶液反应生成溴代产物
B.发生水解反应
C.与溴的CCl4溶液发生加成反应
D.发生消去反应
E.催化氧化生成含羰基的化合物
(5)P的同分异构体较多,其中一类与F互为同系物且氮原子与苯环直接相连,此类同分异构体共有9种;另一类同分异构体同时符合下列条件:①属于对位二取代苯且苯环上连接-NH2;②能发生水解.试写出满足此条件的P的所有同分异构体的结构简式:
 、
、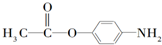 、
、 .
.
分析 A发生催化氧化生成B,则A中含有2个C原子、4个H原子,A分子的核磁共振氢谱只有一个吸收峰且能使溴水褪色,则A结构简式为CH2═CH2,B能发生氧化反应生成C,C反应生成D,根据D结构简式知,B结构简式为CH3CHO、C结构简式为CH3COOH,D是乙酸酐;E发生取代反应生成F,则E结构简式为 ,D和对羟基苯胺反应生成P,根据P分子式知,发生取代反应,P结构简式为
,D和对羟基苯胺反应生成P,根据P分子式知,发生取代反应,P结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:A发生催化氧化生成B,则A中含有2个C原子、4个H原子,A分子的核磁共振氢谱只有一个吸收峰且能使溴水褪色,则A结构简式为CH2═CH2,B能发生氧化反应生成C,C反应生成D,根据D结构简式知,B结构简式为CH3CHO、C结构简式为CH3COOH,D是乙酸酐;E发生取代反应生成F,则E结构简式为 ,D和对羟基苯胺反应生成P,根据P分子式知,发生取代反应,P结构简式为
,D和对羟基苯胺反应生成P,根据P分子式知,发生取代反应,P结构简式为 ,
,
(1)通过以上分析知,A结构简式为CH2═CH2,故答案为:CH2═CH2;
(2)C发生取代反应生成D,结构简式为2CH3COOH→(CH3CO)2O+H2O,故答案为:2CH3COOH→(CH3CO)2O+H2O;
(3)反应②的反应类型为是取代反应,P结构简式为 ,P在碱性条件下反应方程式为
,P在碱性条件下反应方程式为 ,
,
故答案为:取代反应; ;
;
(4)W的结构简式为 ,W的酸性水解产物结构简式为HOOCCH2CH(OH)CH2OH,其名称是3,4-二羟基丁酸,
,W的酸性水解产物结构简式为HOOCCH2CH(OH)CH2OH,其名称是3,4-二羟基丁酸,
A.含有醇羟基,所以与浓HBr溶液反应生成溴代产物,故不选;
B.含有酯基,所以发生水解反应,故不选;
C.苯环碳碳不饱和键,所以不能与溴的CCl4溶液发生加成反应,故选;
D.含有醇羟基且连接醇羟基碳原子相邻碳原子上含有氢原子,所以能发生消去反应,故不选;
E.醇羟基能发生催化氧化生成羰基,所以能催化氧化生成含羰基的化合物,故不选;
故答案为:3,4-二羟基丁酸;C;
(5)P为 ,P的同分异构体较多,其中一类与F互为同系物且氮原子与苯环直接相连,说明含有苯环且含有硝基,如果含有乙基,则有邻间对三种结构;
,P的同分异构体较多,其中一类与F互为同系物且氮原子与苯环直接相连,说明含有苯环且含有硝基,如果含有乙基,则有邻间对三种结构;
如果含有两个甲基,如果两个甲基处于邻位,有两种结构;
如果两个甲基处于间位,有三种结构;
如果两个甲基处于对位,有一种结构;所以符合条件的有3+2+1+3=9种;
另一类同分异构体同时符合下列条件:
①属于对位二取代苯且苯环上连接-NH2;
②能发生水解,说明含有酯基,
符合条件的结构简式有 、
、 、
、 ,
,
故答案为:9; 、
、 、
、 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确有机物反应类型、反应条件及断键和成键方式是解本题关键,难点是限制型同分异构体种类判断,题目难度中等.

 名校课堂系列答案
名校课堂系列答案(1)原高碘酸盐(IO65-)、过二硫酸盐(S2O82-)、二氧化铅(PbO2)是三种具有强氧化性的物质,均能在一定条件下将Mn2+氧化为高锰酸盐.回答下列问题:
①基态锰原子能量最高能级电子排布图为
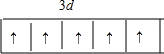 .
.②过二硫酸根离子中两个硫原子间存在过氧键,写出过硫酸根离子的结构简式
 .
.③碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如表所示:
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(2)利用铜萃取剂M,通过如下反应实现铜离子的富集:
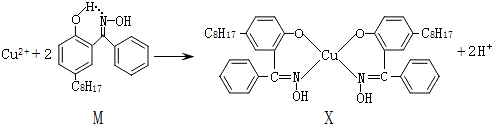
①X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
②X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为N>O>C.
③上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键 f.氢键
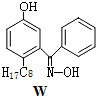
④M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
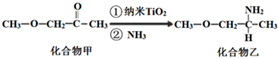
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图.化合物乙中手性碳原子有1个,化合物乙的沸点明显高于化合物甲,主要原因是化合物乙分子间形成氢键.化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为O>N>C.
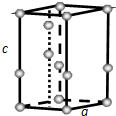
(4)常压下,水冷却至0℃以下,即可结晶成六方晶系的冰.日常生活中见到的冰、霜和雪等都是属于这种结构,其晶胞如图所示(只显示氧原子,略去氢原子),晶胞参数侧棱c=737pm,菱形底边a=452pm,底面菱形的锐角是60°.则:冰的密度=ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{{a}^{2}•sin60°}$=$\frac{\frac{18×4}{6.02×1{0}^{23}}}{45{2}^{2}×737×0.866×(1{0}^{-10})^{3}}$=0.917 g/cm3(代值列计算式).
| A. | 影响化学反应速率的因素与化学物质本身无关 | |
| B. | 反应物颗粒越小,其表面积就越小,化学反应速率就越慢 | |
| C. | 加入催化剂一定能够加快化学反应速率 | |
| D. | 增大反应物的浓度和升高反应物的温度都可以加快化学反应速率 |
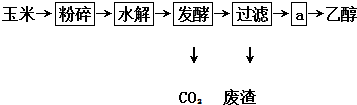
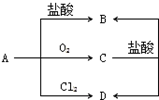 已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系如图所示:
已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系如图所示:
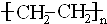 ;②C→D:CH3COOH+CH3CH2OH
;②C→D:CH3COOH+CH3CH2OH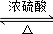 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.