题目内容
7.由下列实验事实所列出的相应结论正确的是( )| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中可能含有SO42- |
| C | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为血红色 | 该Fe(NO3)2试样已经变质 |
| D | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.电解质属于化合物,Cl2是单质;
B.加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该沉淀可能为BaSO4或AgCl;
C.Fe(NO3)2试样加水溶解,加稀硫酸酸化过程中亚铁离子被硝酸氧化;
D.二氧化硫被氧化为硫酸根离子,最后生成硫酸钡沉淀.
解答 解:A.Cl2是单质,因此既不是电解质也不是非电解质,故A错误;
B.加入盐酸酸化的氯化钡溶液,有白色沉淀生成,溶液中可能存在Ag+或SO42-,故B正确;
C.Fe(NO3)2试样加水溶解,加稀硫酸酸化过程中亚铁离子被硝酸氧化生成铁离子,因此不能判定Fe(NO3)2试样是否变质,故C错误;
D.二氧化硫被氧化为硫酸根离子,最后生成硫酸钡沉淀,而BaSO3溶于强酸,故D错误;
故选B.
点评 本题考查化学实验方案的评价,涉及电解质、氧化还原反应、硝酸和二氧化硫的性质等,侧重物质性质的考查,题目难度不大.

练习册系列答案
相关题目
17.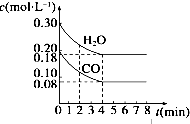 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H>0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30 mol CO、0.10 mol H2O、0.20 mol CO2和20mol H2,则反应将向正反应方向进行 |
18.化学中常借助曲线图来表示某种变化过程,如①平衡移动过程、②中和滴定过程、③沉淀的生成和溶解、④固体物质的溶解度变化过程等,下列曲线图中从左到右依次表示上述过程中的( )


| A. | ①②③④ | B. | ②③①④ | C. | ④③②① | D. | ②①③④ |
15.下列说法不正确的是( )
| A. | Al2O3的熔点高,可用作耐火材料 | |
| B. | NaHCO3与盐酸反应,可用于治疗胃酸过多 | |
| C. | SO2可污染环境,不可用于杀菌、消毒 | |
| D. | 二氧化氮、氨气、氯气和二氧化硫都是易液化的气体 |
2.下列与金属腐蚀有关的说法,正确的是( )

| A. | 图1中,铁钉易生锈 | |
| B. | 图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
12.已知硝酸钾的溶解度随温度的升高而增大,下列叙述正确的是( )
| A. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均增大 | |
| B. | 把60℃的硝酸钾饱和溶液降温到30℃,溶液仍饱和,溶液的质量分数和物质的量浓度均不变 | |
| C. | 60℃硝酸钾饱和溶液中含有的溶质的质量比30℃的硝酸钾饱和溶液中多 | |
| D. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均不变 |
14.化学与生活息息相关.不列说法正确的是( )
| A. | 医用酒精的浓度通常是95% | |
| B. | 淀粉、纤维素、蛋白质和油脂都属于天然高分子化合物 | |
| C. | 用食醋可除去热水壶内壁的水垢 | |
| D. | 生活中常用明矶对水进行处理,起净化、杀菌、消毒作用 |
15. 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )| A. | K与N相接时,H+向负极区迁移 | |
| B. | 铅蓄电池属于一次电 | |
| C. | K与N相接时,能量由化学能转化为电能 | |
| D. | K与M连接时,所用电的a极为负极 |