题目内容
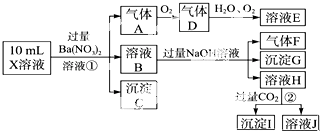
19.等体积的A1C13和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则AlCl3和NaOH两种溶液的物质的量浓度之比为2:3或2:7.分析 将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝元素存在形式可能为AlCl3或NaAlO2,令氢氧化铝的物质的量为1mol,则溶液中AlCl3或NaAlO2也是1mol,结合反应:Al3++3OH-═Al(OH)3↓、Al3++4OH-=AlO2-+2H2O,讨论进行计算.
解答 解:等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,令氢氧化铝的物质的量为1mol,则溶液中AlCl3或NaAlO2也是1mol,
若溶液中含铝元素以Al3+形式存在,NaOH完全反应,则:
Al3++3OH-═Al(OH)3
1mol 3mol 1mol
则原来AlCl3的物质的量为1mol+1mol=2mol,NaOH为3mol,则:AlCl3和NaOH两种溶液物质的量浓度之比=2mol:3mol=2:3,
若溶液中含铝元素以AlO2-形式存在,则:
Al3++3OH-═Al(OH)3
1mol 3mol 1mol
Al3++4OH-═AlO2-+2H2O,
1mol 4mol 1mol
则原来AlCl3的物质的量为1mol+1mol=2mol,NaOH为3mol+4mol=7mol,则:AlCl3和NaOH两种溶液物质的量浓度之比=2mol:7mol=2:7,
故答案为:2:3或2:7.
点评 本题考查化学方程式有关计算,难度中等,判断溶液中Al元素存在形式是关键,再结合方程式计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法正确的是( )
| A. | 将(CH3)3CCH2Cl与氢氧化钾的乙醇溶液加热一段时间后冷却,再滴加硝酸酸化的硝酸银溶液,可观察到有白色沉淀产生 | |
| B. | 新制氢氧化铜悬浊液可检验失去标签的乙醛、乙酸、乙酸乙酯(必要时可加热) | |
| C. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| D. | 向淀粉溶液中加稀硫酸,加热几分钟,冷却后加入新制氢氧化铜悬浊液,若加热后未见砖红色沉淀生成,说明淀粉未开始水解 |
7.由下列实验事实所列出的相应结论正确的是( )
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中可能含有SO42- |
| C | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为血红色 | 该Fe(NO3)2试样已经变质 |
| D | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| A. | A | B. | B | C. | C | D. | D |
14. 如图为2012年第29届伦敦奥运会使用的火炬,火炬中的燃料是丙烷(燃烧热为2221.5kJ/mol).下列正确的是( )
如图为2012年第29届伦敦奥运会使用的火炬,火炬中的燃料是丙烷(燃烧热为2221.5kJ/mol).下列正确的是( )
 如图为2012年第29届伦敦奥运会使用的火炬,火炬中的燃料是丙烷(燃烧热为2221.5kJ/mol).下列正确的是( )
如图为2012年第29届伦敦奥运会使用的火炬,火炬中的燃料是丙烷(燃烧热为2221.5kJ/mol).下列正确的是( )| A. | 丙烷燃烧的过程中,化学能全部转化为热能 | |
| B. | 丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)→3CO2(g)+4H20(g);△H=-2221.5 kJ•mol-1 | |
| C. | 丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)→3CO2(g)+4H20(l);△H=-2221.5 kJ•mol-1 | |
| D. | 1mol丙烷若先分解生成C、H2,然后C、H2再完全燃烧放出的特例小于2221.5kJ |
9. 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
Ⅰ、已知反应N2O4(g)?2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.
下列说法能说明透光率不再发生改变的有ad.
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
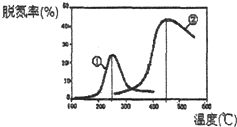
Ⅱ、用NH3催化还原NOx可以消除氮氧化物的污染.如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g).
(1)该反应的△S>0(填“>”、“=”或“<”).
(2)以下说法正确的是C.
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
Ⅲ、用CH4催化还原NOx也可以消除氮氧化物的污染.
(3)已知:CH4(g)的燃烧热为890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-844KJ/mol.
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
①温度为T1℃时,0~20min内,v(CH4)=0.0125mol/(L.s).
②T1<T2(填“>”或“<”,下空同);判断理由是升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应.
③T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减小 (填“增大”、“减小”或“不变”).
 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.Ⅰ、已知反应N2O4(g)?2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.
下列说法能说明透光率不再发生改变的有ad.
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
Ⅱ、用NH3催化还原NOx可以消除氮氧化物的污染.如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g).
(1)该反应的△S>0(填“>”、“=”或“<”).
(2)以下说法正确的是C.
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
Ⅲ、用CH4催化还原NOx也可以消除氮氧化物的污染.
(3)已知:CH4(g)的燃烧热为890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-844KJ/mol.
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
②T1<T2(填“>”或“<”,下空同);判断理由是升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应.
③T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减小 (填“增大”、“减小”或“不变”).
6.下列说法正确的是( )
| A. | 乙烯的结构简式为CH2=CH2,可以用作果实催熟剂 | |
| B. | 淀粉和纤维素分子式均可表示成(C6H10O5)n,它们互为同分异构体 | |
| C. | 己烷和苯可以用酸性高锰酸钾溶液来鉴别 | |
| D. | 糖类、油脂、蛋白质都可以发生水解反应 |
7.下列分子中,含有σ键而不含π键的是( )
| A. | N2 | B. | Cl2 | C. | CH3CH3 | D. | C2H2 |