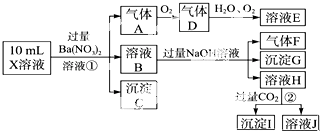
题目内容
14.化学与生活息息相关.不列说法正确的是( )| A. | 医用酒精的浓度通常是95% | |
| B. | 淀粉、纤维素、蛋白质和油脂都属于天然高分子化合物 | |
| C. | 用食醋可除去热水壶内壁的水垢 | |
| D. | 生活中常用明矶对水进行处理,起净化、杀菌、消毒作用 |
分析 A.医用酒精浓度通常是75%;
B.相对分子质量在10000以上的化合物为高分子化合物;
C.强酸能和弱酸盐反应生成弱酸,乙酸酸性大于碳酸,能和碳酸盐反应生成二氧化碳和水;
D.明矾水解生成的氢氧化铝胶体具有吸附性,能净化水,但氢氧化铝胶体没有强氧化性.
解答 解:A.酒精的浓度过大,对人体有害,则医用酒精的浓度通常为75%,故A错误;
B.相对分子质量在10000以上的化合物为高分子化合物,油脂的相对分子质量较小,属于小分子化合物,淀粉、蛋白质和纤维素是天然高分子化合物,故B错误;
C.强酸能和弱酸盐反应生成弱酸,乙酸酸性大于碳酸,乙酸能和碳酸钙反应生成二氧化碳和水、醋酸钙,所以用食醋可除去热水壶内壁的水垢,故C正确;
D.明矾水解生成的氢氧化铝胶体具有吸附性,能净化水,但氢氧化铝胶体没有强氧化性,所以明矾水溶液不能杀菌消毒,故D错误;
故选C.
点评 本题考查化学与生活,涉及盐类水解、难溶物溶解平衡、高分子化合物等知识点,为高频考点,明确化学反应原理及物质性质是解本题关键,易错选项是D,注意明矾净水原理是利用胶体吸附性而不是氧化性,题目难度不大.

练习册系列答案
相关题目
6.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol PbO2反应所需Cr3+的物质的量为( )
| A. | 0.75 mol | B. | 1.5 mol | C. | 1.0 mol | D. | 0.67 mol |
7.由下列实验事实所列出的相应结论正确的是( )
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中可能含有SO42- |
| C | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为血红色 | 该Fe(NO3)2试样已经变质 |
| D | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| A. | A | B. | B | C. | C | D. | D |
9. 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
Ⅰ、已知反应N2O4(g)?2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.
下列说法能说明透光率不再发生改变的有ad.
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
Ⅱ、用NH3催化还原NOx可以消除氮氧化物的污染.如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g).
(1)该反应的△S>0(填“>”、“=”或“<”).
(2)以下说法正确的是C.
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
Ⅲ、用CH4催化还原NOx也可以消除氮氧化物的污染.
(3)已知:CH4(g)的燃烧热为890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-844KJ/mol.
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
①温度为T1℃时,0~20min内,v(CH4)=0.0125mol/(L.s).
②T1<T2(填“>”或“<”,下空同);判断理由是升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应.
③T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减小 (填“增大”、“减小”或“不变”).
 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.Ⅰ、已知反应N2O4(g)?2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.
下列说法能说明透光率不再发生改变的有ad.
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
Ⅱ、用NH3催化还原NOx可以消除氮氧化物的污染.如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g).
(1)该反应的△S>0(填“>”、“=”或“<”).
(2)以下说法正确的是C.
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
Ⅲ、用CH4催化还原NOx也可以消除氮氧化物的污染.
(3)已知:CH4(g)的燃烧热为890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-844KJ/mol.
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
②T1<T2(填“>”或“<”,下空同);判断理由是升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应.
③T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减小 (填“增大”、“减小”或“不变”).
19.海水开发利用的部分过程如图所示.下列说法错误的是( )
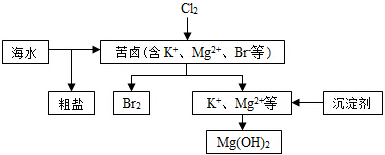

| A. | 向苦卤中通入Cl2,目的是为了提取溴 | |
| B. | 除去粗盐中的SO42-杂质,可以选择BaCl2等试剂 | |
| C. | 工业生产常选用Ca(OH)2作为沉淀剂 | |
| D. | 电解法制取金属镁时,原料一般是灼烧Mg (OH)2得到的MgO |
6.下列说法正确的是( )
| A. | 乙烯的结构简式为CH2=CH2,可以用作果实催熟剂 | |
| B. | 淀粉和纤维素分子式均可表示成(C6H10O5)n,它们互为同分异构体 | |
| C. | 己烷和苯可以用酸性高锰酸钾溶液来鉴别 | |
| D. | 糖类、油脂、蛋白质都可以发生水解反应 |
4.某物质的焰色反应为黄色,则下列判断正确的是( )
| A. | 一定含钠的单质 | B. | 一定是钠的化合物 | ||
| C. | 一定含有钠元素,可能含有钾元素 | D. | 一定含有钾元素 |