题目内容
3.下列实验设计能达到目的是( )| 选项 | 实验方案 | 实验目的 |
| A | 金属甲、乙在氢氧化钠溶液中构成原电池 | 验证甲、乙的活性强弱 |
| B | 用惰性电极电解不同浓度的AgNO3和Cu(NO3)2的混合溶液 | 证明单质铜比银活泼 |
| C | 在氢氧化镁和氢氧化钠溶液中加入氯化铁溶液 | 证明Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
| D | 测定0.1mol•L-1Na2X、0.1mol•L-1Na2Y溶液的pH | 验证H2X和H2Y酸性的相对强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.能与氢氧化钠反应的金属只有铝,活泼性比铝强的金属反而与氢氧化钠溶液不反应;
B.浓度不铜,不能进行比较;
C.含有氢氧化钠,加入氯化铁生成氢氧化铁沉淀,不存在难溶电解质的溶解平衡移动;
D.酸越弱,对应的钠盐水解程度越大.
解答 解:A.不能通过金属在氢氧化钠溶液失电子判断其活泼性相对较弱,如镁,铝、铁,铝,因能与氢氧化钠反应的金属只有铝,故A错误;
B.浓度不铜,不能进行比较,如硝酸铜浓度较大,则先析出铜,故B错误;
C.含有氢氧化钠,加入氯化铁生成氢氧化铁沉淀,如证明存在难溶电解质的溶解平衡移动,可在氢氧化镁浊液中滴加氯化铁,故C错误;
D.酸越弱,对应的钠盐水解程度越大,通过测定pH,可验证H2X和H2Y酸性的相对强弱,故D正确.
故选D.
点评 本题考查化学实验方案的设计,为高频考点,涉及原电池以及难溶电解质的溶解平衡、弱电解质的电离等,把握相关反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
13.下列电离方程式正确的是( )
| A. | NH3•H2O═NH4++OH- | B. | H2S?S2-+2H+ | ||
| C. | CaCO3?Ca2++CO32- | D. | CH3COONH4═CH3COO-+NH4+ |
14.下列物质中具含离子键又含共价键的是( )
| A. | HCl | B. | Cl2 | C. | Na2O2 | D. | NaOH |
18.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol•L-1 Na2CO3溶液中,含CO${\;}_{3}^{2-}$数目小于NA | |
| B. | 1mol FeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| D. | 1mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
15.化学与社会、生活密切相关,对下列蔑象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B | 常温下,在足量的浓、稀硝酸中分别加入相同的铝片,浓硝酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 | 乙酸乙酯是非电解质,它不能导电,它的水解产物乙酸是电解质(弱酸) |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含Cu2+的溶液中置换出铜 |
12.(1)常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①0.2mol/LHCl溶液中由水电离出的c(H+)<0.2mol/LMOH溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=9.9×10-7mol/L.
(2)常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH>7,则说明在相同条件下MOH的电离程度>MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,则混合溶液的pH无法确定.(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示:
①待测NaOH溶液的物质的量浓度为0.1149mol/L.(保留四位有效数字).
②下列情况可能引起测定结果偏高的是BC.
A.锥形瓶未用待测液润洗
B.酸式滴定管未用标准盐酸溶液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是下列中的B.
A.KI B.K2CrO4 C.KBr D.K2S.
①0.2mol/LHCl溶液中由水电离出的c(H+)<0.2mol/LMOH溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=9.9×10-7mol/L.
(2)常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH>7,则说明在相同条件下MOH的电离程度>MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,则混合溶液的pH无法确定.(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示:
| 实验序号 | 0.1032mol/LHCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 25.53 | 25.00 |
| 3 | 27.85 | 25.00 |
②下列情况可能引起测定结果偏高的是BC.
A.锥形瓶未用待测液润洗
B.酸式滴定管未用标准盐酸溶液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
A.KI B.K2CrO4 C.KBr D.K2S.
 如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:
如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题: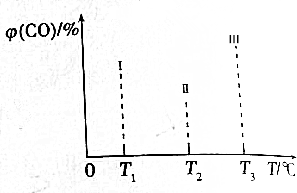
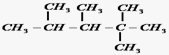
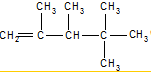 、
、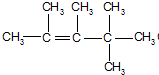 、
、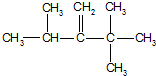 .
.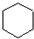 ,E是CH3CH3.
,E是CH3CH3. .
.