题目内容
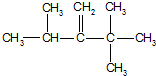
13.(1)某烯烃,经与氢气加成反应可得到结构简式为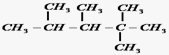
的烷烃,则此烯烃可能的结构简式是:
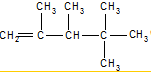 、
、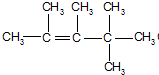 、
、 .
.(2)某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.
①用系统命名法给A命名:2,3-二甲基-2-丁烯.
②A中的碳原子是否都处于同一平面?是(填“是”或者“不是”).
(3)有A、B、C、D、E 5种烃,各取0.01mol充分燃烧后,B、C、E所产生的二氧化碳均为448mL(标准状况);A或D燃烧所得的二氧化碳都是前者的3倍.在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,其中A 可以转化为D,B可以转变为C或E,C可以转变为E;B或C都能使高锰酸钾酸性溶液褪色,而A、D、E无此性质;在铁屑存在时A与溴发生取代反应.
①写出烃的结构简式:B是CH≡CH,C是CH2=CH2,D是
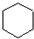 ,E是CH3CH3.
,E是CH3CH3.②写出A与溴反应方程式
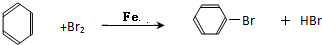 .
.
分析 (1)先判断该烃结构是否对称,如果对称,只考虑该分子一边的结构和对称线两边相邻碳原子即可;如果不对称,要全部考虑,然后各去掉相邻碳原子上的一个氢原子形成双键;
(2)①A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,则A应为烯烃,设分子式为CnH2n,则有14n=84,n=6,又因为核磁共振氢谱表明分子中只有一种类型的氢,其结构简式应为 ;
;
②碳碳双键是平面型结构;
(3)各取0.01mol充分燃烧后,B、C、E所产生的二氧化碳均为448mL.即$\frac{0.448L}{22.4L/mol}$=0.02mol,则B、C、E中都含有2个C原子,A或D燃烧所得的二氧化碳都是前者的3倍,说明A、D的C原子数为6,在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,说明分子中都含有C=C或C≡C,其中A可转化为D,B可以转化为C或E,C可以转化为E,B或C都能使高锰酸钾酸性溶液褪色,说明B为CH≡CH,C为CH2=CH2,E为CH3CH3,而A、D、E无此性质;在铁屑存在时A能与溴发生取代反应A应为 ,加成可生成D为
,加成可生成D为 ,据此答题.
,据此答题.
解答 解:(1)根据烯烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置,因此相应烯烃分子中存在碳碳双键的位置有3种,结构简式为: ;
; ;
; ,故答案为:
,故答案为: ;
; ;
; ;
;
(2)①A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,则A应为烯烃,设分子式为CnH2n,则有14n=84,n=6,又因为核磁共振氢谱表明分子中只有一种类型的氢,其结构简式应为 ,名称为2,3-二甲基-2-丁烯,故答案为:2,3-二甲基-2-丁烯;
,名称为2,3-二甲基-2-丁烯,故答案为:2,3-二甲基-2-丁烯;
②由于碳碳双键是平面型结构,而4个甲基与不饱和碳原子又直接相连,所以6个碳原子处于同一平面上,故答案为:是;
(3)各取0.01mol充分燃烧后,B、C、E所产生的二氧化碳均为448mL.物质的量为:即$\frac{0.448L}{22.4L/mol}$=0.02mol,则B、C、E中都含有2个C原子,A或D燃烧所得的二氧化碳都是前者的3倍,说明A、D的C原子数为6,在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,说明分子中都含有C=C或C≡C,其中A可转化为D,B可以转化为C或E,C可以转化为E,B或C都能使高锰酸钾酸性溶液褪色,说明B为CH≡CH,C为CH2=CH2,E为CH3CH3,而A、D、E无此性质;在铁屑存在时A能与溴发生取代反应A应为 ,A加成可生成D为
,A加成可生成D为 ,
,
①根据分析可知,B为CH≡CH,C为CH2=CH2,D为 ,E为CH3CH3,
,E为CH3CH3,
故答案为:CH≡CH; CH2=CH2; ; CH3CH3;
; CH3CH3;
② 与溴发生取代反应,其反应方程式为:
与溴发生取代反应,其反应方程式为: ,
,
故答案为: .
.
点评 本题考查有机物结构与性质、有机推断,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握常见有机反应类型、原理,试题培养了学生的分析能力及灵活应用能力.

| 选项 | 实验方案 | 实验目的 |
| A | 金属甲、乙在氢氧化钠溶液中构成原电池 | 验证甲、乙的活性强弱 |
| B | 用惰性电极电解不同浓度的AgNO3和Cu(NO3)2的混合溶液 | 证明单质铜比银活泼 |
| C | 在氢氧化镁和氢氧化钠溶液中加入氯化铁溶液 | 证明Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
| D | 测定0.1mol•L-1Na2X、0.1mol•L-1Na2Y溶液的pH | 验证H2X和H2Y酸性的相对强弱 |
| A. | A | B. | B | C. | C | D. | D |
回答下列问题:
①若将PH=3的HA溶液和PH=11的NaOH溶液等体积混合后,溶液的PH值<7(填>、<、=)
②若混合后溶液PH值等于7,则混合后溶液中各离子浓度大小次序为c(A-)=c(Na+)>c(OH-)=c(H+).
(2)已知常温下Ksp[Al(OH)3]=3×10-34;Ksp[Fe(OH)3]=4×10-38在25℃向浓度均为0.1mol/L的AlCl3和FeCl3混合溶液中逐滴加入氨水,
?请写出最先生成沉淀的离子方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.?当溶液PH=10时,C(Al3+)=3×10-22mol/L
(3)1909年化学家哈伯在实验室首次合成了氨.氨的应用较多,据此回答下列问题:合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g);
①写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$.
?②在一定条件下的2L密闭容器中进行实验,并测得下列数据
| 物质 | N2 | H2 | NH3 |
| 起始(mol) | 2 | 7 | 0 |
| 10s(mol) | 1.6 | ||
| 平衡(mol) | 2 |
?③在一定温度,一定体积的密闭容器中进行合成氨的实验,下列不可以判断反应达到平衡状态的为AD.
A、密度保持不变
B、平均分子量保持不变
C、气体的总物质的量保持不变
D、单位时间内每消耗1molN2的同时生成2mol氨气
④汽车尾气中含有较多的NO2和NO若任意排放可形成光化学烟雾,利用NH3可将其除去,同时得到不会污染空气的物质,试写出NH3与NO2反应的化学化学方程式8NH3+6NO2=7N2+12H2O.
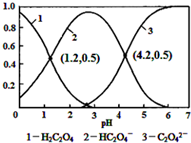
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{O}_{4}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×c(C2O42-)=1000 | |
| C. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2 | |
| D. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一定增大 |
| A. | ①②④ | B. | ①②③ | C. | ①④ | D. | ②④ |
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动
③压强增大,平衡不移动
④加入催化剂,B的转化率提高.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
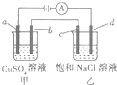 如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 甲烧杯中b电极反应式为:Cu2++2e-═Cu | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 当b极增重3.2g时,d极产生的气体为0.56L(标准状况) |