题目内容
我国探月的目的之一是探测月球土壤厚度和
He的储量.
He是最安全最清洁的能源,地球上仅有15t左右,而月球上的
He估计在1.0×106~1.5×106t.地球上氦元素主要以
He的形式存在.已知一个12C原子的质量为a g,一个
He原子的质量为b g,NA为阿伏加德罗常数.下列说法正确的是( )
3 2 |
3 2 |
3 2 |
4 2 |
3 2 |
A、
| ||||
| B、氦元素的近似相对原子质量为3 | ||||
C、
| ||||
D、
|
考点:质量数与质子数、中子数之间的相互关系
专题:原子组成与结构专题
分析:A.有相同质子数,不同中子数的原子互为同位素;
B.元素的近似平均相对原子质量为同位素的质量数乘以该同位素原子在自然界所占原子个数的百分数;
C.原子的相对原子质量是指该原子质量与12C原子质量的1/12的比值;
D.原子的摩尔质量=该原子的质量×阿伏伽德罗常数.
B.元素的近似平均相对原子质量为同位素的质量数乘以该同位素原子在自然界所占原子个数的百分数;
C.原子的相对原子质量是指该原子质量与12C原子质量的1/12的比值;
D.原子的摩尔质量=该原子的质量×阿伏伽德罗常数.
解答:
解:A.
He和
He质子数相同,中子数不同,故互为同位素,故A错误;
B.
He原子的近似相对原子质量为3,元素的近似平均相对原子质量为同位素的质量数乘以该同位素原子在自然界所占原子个数的百分数,故B错误;
C.
He的相对原子质量为
=
,故C正确;
D.
He的摩尔质量为bNAg/mol,故D错误;
故选C.
3 2 |
4 2 |
B.
3 2 |
C.
3 2 |
| b | ||
|
| 12b |
| a |
D.
3 2 |
故选C.
点评:本题考查同位素、元素的近似相对原子质量、原子的相对原子质量的概念,及摩尔质量的计算,难度中等.要注意基础知识的积累.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
下列说法与盐的水解无关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤将FeCl3溶液蒸干并灼烧,得到的固体是Fe2O3;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤将FeCl3溶液蒸干并灼烧,得到的固体是Fe2O3;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
| A、①③⑥ | B、②③⑤ |
| C、③④⑤ | D、全有关 |
用如图实验装置进行相应实验,能达到实验目的是( )

| A、用图1所示装置分离沸点相差较大的互溶液体混合物 |
| B、用图2所示装置蒸干FeCl2饱和溶液制备FeCl2晶体 |
| C、用图3所示装置稀释浓硫酸 |
| D、用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
将 0.2mol的某烷烃完全燃烧后,生成的气体缓缓全部缓慢通过0.5L 2mol/L NaOH溶液中,生成的碳酸钠和碳酸氢钠的物质的量之比为1:3,则该烷烃是( )
| A、CH4 |
| B、C2H6 |
| C、C3H8 |
| D、C4H10 |
下列关于图的实验装置说法正确的是( )
A、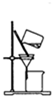 该图装置可以提纯精制氢氧化铁胶体 |
B、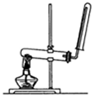 该图装置可以用来制备和收集氨气和氧气 |
C、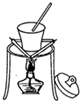 该图可以从食盐水中得到食盐晶体 |
D、 该图试管中放新制FeSO4溶液,从滴管中滴加NaOH溶液,易于观察到Fe(OH)2颜色 |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A、1 mol碳正离子(CH+3)所含的电子总数为8NA | ||
| B、1 mol甲基(-CH3)所含的电子总数为9NA | ||
| C、0.5 摩1,3-丁二烯分子中含有C=C双键数为 NA | ||
D、标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为
|
1.2mol Cl2与元素A单质完全反应生成0.80mol AClx,则x值为( )
| A、1 | B、2 | C、3 | D、4 |
H2O与H2S结构相似,都是V型的极性分子,但是H2O的沸点是100℃,H2S的沸点是-60.7℃.引起这种差异的主要原因是( )
| A、范德华力 | B、共价键 |
| C、氢键 | D、相对分子质量 |