题目内容
下列说法正确的是( )
| A、1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1 mol?L-1 |
| B、从1L2 mol?L-1的硫酸溶液中取出0.5L,该溶液的浓度为1 mol?L-1 |
| C、配制500mL0.5 mol?L-1的硫酸铜溶液,需要62.5g胆矾 |
| D、中和100mL1 mol?L-1的硫酸溶液,需要NaOH 4g |
考点:物质的量浓度,溶液的配制
专题:物质的量浓度和溶解度专题
分析:A、1L水中溶解了58.5gNaCl,溶液体积不是1L;
B、溶液时均一稳定的分散系,溶质浓度和溶液体积无关;
C、依据n=CV计算物质的量结合m=nM计算得到;
D、硫酸和氢氧化钠反应按照物质的量2:1恰好反应.
B、溶液时均一稳定的分散系,溶质浓度和溶液体积无关;
C、依据n=CV计算物质的量结合m=nM计算得到;
D、硫酸和氢氧化钠反应按照物质的量2:1恰好反应.
解答:
解:A、1L水中溶解了58.5gNaCl,氯化钠物质的量=1mol,溶液体积大于1L,该溶液的物质的量浓度小于1 mol?L-1,故A错误;
B、溶液时均一稳定的分散系,溶质浓度和溶液体积无关,从1L2 mol?L-1的硫酸溶液中取出0.5L,该溶液的浓度为2mol?L-1,故B错误;
C、依据n=CV计算物质的量结合m=nM计算得到,配制500mL0.5 mol?L-1的硫酸铜溶液,溶质硫酸铜物质的量=0.5L×0.5mol/L=0.25mol,需要胆矾质量=0.25mol×250g/mol=62.5g,故C正确;
D、硫酸和氢氧化钠反应按照物质的量2:1恰好反应,中和100mL1 mol?L-1的硫酸溶液,需要NaOH物质的量为0.2mol,需要氢氧化钠质量=40g/mol×0.2mol=8g,故D错误;
故选C.
B、溶液时均一稳定的分散系,溶质浓度和溶液体积无关,从1L2 mol?L-1的硫酸溶液中取出0.5L,该溶液的浓度为2mol?L-1,故B错误;
C、依据n=CV计算物质的量结合m=nM计算得到,配制500mL0.5 mol?L-1的硫酸铜溶液,溶质硫酸铜物质的量=0.5L×0.5mol/L=0.25mol,需要胆矾质量=0.25mol×250g/mol=62.5g,故C正确;
D、硫酸和氢氧化钠反应按照物质的量2:1恰好反应,中和100mL1 mol?L-1的硫酸溶液,需要NaOH物质的量为0.2mol,需要氢氧化钠质量=40g/mol×0.2mol=8g,故D错误;
故选C.
点评:本题考查了溶质浓度和离子浓度关系,酸碱反应定量关系计算,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验事故的处理,不正确的是( )
| A、洒出的酒精在桌上燃烧起来,不要惊慌,应立即用抹布扑盖 |
| B、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| C、不慎将碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀醋酸 |
| D、衣服小处着火时,应立即用湿布压灭火焰;如果燃烧面积较大,应立即脱去衣服或躺在地上打几个滚 |
某物质的晶体内部一个截面上原子的排布情况如图所示,则该晶体的化学式可表示为( )


| A、A2B |
| B、AB |
| C、AB2 |
| D、A3B |
下列反应属于放热反应的是( )
| A、NaOH溶于水 | ||||
B、C+CO2
| ||||
| C、KClO3受热分解 | ||||
| D、Al与稀盐酸反应 |
下列说法正确的是( )
| A、金属腐蚀就是金属失去电子被还原的过程 |
| B、将水库中的水闸(钢板)与外加直接电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
| C、由原电池原理知所有的合金都比纯金属更易被腐蚀 |
| D、铜板上的铁铆钉处在潮湿的空气中发生:Fe-3e-═Fe3+,从而形成铁锈,但此过程铜不被腐蚀 |
下列说法中正确的是( )
| A、对垃圾进行分类要严格执行国际统一的标准 |
| B、对垃圾进行分类的主要目的是便于垃圾的存放 |
| C、凡是废纸都可以归为纸类垃圾进行回收 |
| D、学生在课堂上用过的废纸可以积攒起来进行回收利用 |
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、最简单气态氢化物的热稳定性:R>Q |
| B、最高价氧化物对应水化物的酸性:Q>W |
| C、原子半径:T>Q>R |
| D、Q最高价氧化物形成的晶体熔点很低 |
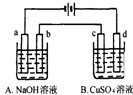 按如图装置进行电解(均是惰性电极),已知A烧杯中装有500mL20%的NaOH溶液,B烧杯中装有500mL pH为6的1mol?L-1CuSO4溶液.通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)( )
按如图装置进行电解(均是惰性电极),已知A烧杯中装有500mL20%的NaOH溶液,B烧杯中装有500mL pH为6的1mol?L-1CuSO4溶液.通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)( )