题目内容
X、Y、Z、W为四种短周期元素,已知X、Z同主族,Y2+、Z-、W+三种离子的电子层结构与氖原子相同,下列排序正确的是( )
| A、碱性:Y(OH)2>WOH |
| B、阴离子的还原性:X->Z- |
| C、原子半径:W>Y>Z>X |
| D、气态氢化物的稳定性:HX>HZ |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W为四种短周期元素,Y2+、Z-、W+三种离子的电子层结构与氖原子相同,则Y是Mg元素、Z是F元素、W是Na元素,X、Z同主族,且都是短周期元素,则X是Cl元素,
A.元素的金属性越强,其最高价氧化物的水化物碱性越强;
B.元素的非金属性越强,其简单阴离子的还原性越弱;
C.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
C.元素非金属性越强,其气态氢化物越稳定.
A.元素的金属性越强,其最高价氧化物的水化物碱性越强;
B.元素的非金属性越强,其简单阴离子的还原性越弱;
C.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
C.元素非金属性越强,其气态氢化物越稳定.
解答:
解:X、Y、Z、W为四种短周期元素,Y2+、Z-、W+三种离子的电子层结构与氖原子相同,则Y是Mg元素、Z是F元素、W是Na元素,X、Z同主族,且都是短周期元素,则X是Cl元素,
A.元素的金属性越强,其最高价氧化物的水化物碱性越强,Y是Mg元素、W是Na元素,金属性W>Y,则碱性:Mg(OH)2<NaOH,故A错误;
B.元素的非金属性越强,其简单阴离子的还原性越弱,X是Cl元素、Z是F元素,非金属性F>Cl,则阴离子的还原性:X->Z-,故B正确;
C.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,F原子电子层数最少,其原子半径最小,Na、Mg、Cl原子电子层数相同且原子序数依次增大,则原子半径大小顺序是Na>Mg>Cl>F,故C错误;
C.元素非金属性越强,其气态氢化物越稳定,X是Cl元素、Z是F元素,非金属性F>Cl,气态氢化物的稳定性HX<HZ,故D错误;
故选B.
A.元素的金属性越强,其最高价氧化物的水化物碱性越强,Y是Mg元素、W是Na元素,金属性W>Y,则碱性:Mg(OH)2<NaOH,故A错误;
B.元素的非金属性越强,其简单阴离子的还原性越弱,X是Cl元素、Z是F元素,非金属性F>Cl,则阴离子的还原性:X->Z-,故B正确;
C.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,F原子电子层数最少,其原子半径最小,Na、Mg、Cl原子电子层数相同且原子序数依次增大,则原子半径大小顺序是Na>Mg>Cl>F,故C错误;
C.元素非金属性越强,其气态氢化物越稳定,X是Cl元素、Z是F元素,非金属性F>Cl,气态氢化物的稳定性HX<HZ,故D错误;
故选B.
点评:本题考查同一周期、同一主族元素性质递变规律,明确金属性、非金属强弱判断方法是解本题关键,侧重考查学生灵活运用能力,知道原子半径或离子半径的比较方法,题目难度不大.

练习册系列答案
相关题目
对下列实验的描述正确的是( )
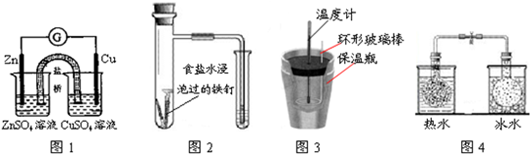

| A、图1所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性 |
| B、图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
| C、图3所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热 |
| D、图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是放热反应 |
组成C3H2Cl6 的卤代烃,可能的同分异构体有( )
| A、6种 | B、5种 | C、4种 | D、3种 |

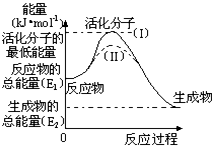 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题. 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.