题目内容
为测定某种小苏打样品中所含无水Na2CO3的质量分数,设计如下实验方案:
(1)方案一:加热分解法
原理:将一定质量的样品放在已知质量的 (填仪器名称)中加热到质量不发生变化,测出冷却后质量.
(2)方案二:测气体质量法,按如图装置进行实验.并回答以下问题.

①为了保证实验的准确性,分液漏斗中应该装 (填试剂名称),D装置的作用是 .
②实验中除称量样品质量外,还需称量 (填装置序号)装置前后质量的变化.
③根据此实验得到的数据计算,测定结果肯定有误差.因为实验装置还存在一个明显缺陷,该缺陷是 .
(3)方案三:测沉淀质量法
称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤、洗涤,干燥沉淀,称量固体质量.
①过滤操作中,除了烧杯外还需用到的玻璃仪器有 ;
②实验中判断沉淀是否完全的方法是 .
③如加入试剂改为氢氧化钡,已知称得样品19g,干燥沉淀的质量为39.4g,则样品中碳酸钠的质量分数为 .
(1)方案一:加热分解法
原理:将一定质量的样品放在已知质量的
(2)方案二:测气体质量法,按如图装置进行实验.并回答以下问题.

①为了保证实验的准确性,分液漏斗中应该装
②实验中除称量样品质量外,还需称量
③根据此实验得到的数据计算,测定结果肯定有误差.因为实验装置还存在一个明显缺陷,该缺陷是
(3)方案三:测沉淀质量法
称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤、洗涤,干燥沉淀,称量固体质量.
①过滤操作中,除了烧杯外还需用到的玻璃仪器有
②实验中判断沉淀是否完全的方法是
③如加入试剂改为氢氧化钡,已知称得样品19g,干燥沉淀的质量为39.4g,则样品中碳酸钠的质量分数为
考点:探究物质的组成或测量物质的含量,钠的重要化合物
专题:实验探究和数据处理题
分析:(1)灼烧固体在坩埚中进行;
(2)样品和酸反应生成二氧化碳气体,考虑酸的挥发,应选难挥发的稀硫酸,B装置应是干燥气体二氧化碳,C装置吸收二氧化碳,防止空气中水和二氧化碳被吸收,连接了D装置;
(3)①根据过滤操作所需仪器分析;
②碳酸钠和氯化钡生成碳酸钡沉淀,若沉淀完全,应无碳酸钠,据此判断所需试剂;
③根据反应方程式列方程组计算.
(2)样品和酸反应生成二氧化碳气体,考虑酸的挥发,应选难挥发的稀硫酸,B装置应是干燥气体二氧化碳,C装置吸收二氧化碳,防止空气中水和二氧化碳被吸收,连接了D装置;
(3)①根据过滤操作所需仪器分析;
②碳酸钠和氯化钡生成碳酸钡沉淀,若沉淀完全,应无碳酸钠,据此判断所需试剂;
③根据反应方程式列方程组计算.
解答:
解:(1)灼烧固体在坩埚中进行,故答案为:坩埚;
(2)①碳酸钠和碳酸氢钠都和酸反应产生二氧化碳,考虑酸的挥发性,应选择难挥发的稀硫酸,D装置吸收空气中水和二氧化碳,防止空气中水和二氧化碳被C装置吸收,造成误差,故答案为:稀硫酸;吸收空气中水和二氧化碳,避免C装置吸收空气中水和二氧化碳;
②应测定原理是通过生成二氧化碳的质量来计算样品中碳酸氢钠和碳酸钠的含量,故除了称量样品质量外,还应称量装置C在反应前后的质量,故答案为:C装置反应前后的质量;
③此测定原理是测定生成二氧化碳的质量,由于装置中二氧化碳没有排出被装置C吸收,故一定有误差,故答案为:装置中二氧化碳没有被排出;
(3)①过滤所用玻璃仪器为烧杯、漏斗、玻璃棒,故答案为:漏斗、玻璃棒;
②碳酸钠和氯化钡反应生成碳酸钡沉淀,检验是否沉淀完全,可取上层清液,继续加入氯化钡,若无沉淀生成,证明沉淀完全,否则没沉淀完全,
故答案为:取上层清液,继续加入氯化钡,若无沉淀生成,证明沉淀完全,否则没沉淀完全;
③设混合物中碳酸钠质量为xg,碳酸氢钠质量为yg,
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,
106 197
x
NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,
84 197
y
则
,解得
,故混合物中碳酸钠的质量分数为
×100%=55.8%,
故答案为:55.8%.
(2)①碳酸钠和碳酸氢钠都和酸反应产生二氧化碳,考虑酸的挥发性,应选择难挥发的稀硫酸,D装置吸收空气中水和二氧化碳,防止空气中水和二氧化碳被C装置吸收,造成误差,故答案为:稀硫酸;吸收空气中水和二氧化碳,避免C装置吸收空气中水和二氧化碳;
②应测定原理是通过生成二氧化碳的质量来计算样品中碳酸氢钠和碳酸钠的含量,故除了称量样品质量外,还应称量装置C在反应前后的质量,故答案为:C装置反应前后的质量;
③此测定原理是测定生成二氧化碳的质量,由于装置中二氧化碳没有排出被装置C吸收,故一定有误差,故答案为:装置中二氧化碳没有被排出;
(3)①过滤所用玻璃仪器为烧杯、漏斗、玻璃棒,故答案为:漏斗、玻璃棒;
②碳酸钠和氯化钡反应生成碳酸钡沉淀,检验是否沉淀完全,可取上层清液,继续加入氯化钡,若无沉淀生成,证明沉淀完全,否则没沉淀完全,
故答案为:取上层清液,继续加入氯化钡,若无沉淀生成,证明沉淀完全,否则没沉淀完全;
③设混合物中碳酸钠质量为xg,碳酸氢钠质量为yg,
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,
106 197
x
| 197x |
| 106 |
NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,
84 197
y
| 197y |
| 84 |
则
|
|
| 10.6g |
| 19g |
故答案为:55.8%.
点评:本题采用多种方法测定碳酸钠质量分数,同时考查学生基本实验操作、实验分析、计算能力、对比能力等,明确实验原理是解本题关键,注意把氯化钡换成氢氧化钡,碳酸氢钠也和氯化钡反应生成碳酸钡沉淀.

练习册系列答案
相关题目
下列说法正确的是( )
| A、第三周期非金属元素含氧酸的酸性从左到右依次增强(除Ar外) |
| B、形成离子键的阴阳离子间只存在静电吸引力 |
| C、HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| D、元素周期律是元素原子核内核外电子排布周期性变化的结果 |



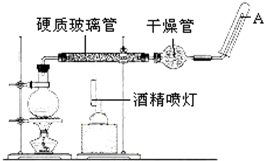 在高温下,Fe与水蒸气可发生反应.应用右边装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
在高温下,Fe与水蒸气可发生反应.应用右边装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
 实验室用乙醇制取乙烯的装置如图,回答下列问题.
实验室用乙醇制取乙烯的装置如图,回答下列问题.