题目内容
9.甲、乙两烧杯中各盛有100mL3mol/L的盐酸和NaOH溶液,向两烧杯中分别加入足量的铝粉,反应结束后再同条件下测得生成的气体体积比为( )| A. | 1:1 | B. | 1:3 | C. | 1:2 | D. | 3:1 |
分析 发生反应为2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,根据n=cV计算出HCl和NaOH的物质的量,然后结合反应方程式计算出生成氢气的物质的量,最高价V=nVm计算出生成氢气体积,据此进行解答.
解答 解:100mL3mol/L的盐酸和NaOH溶液中含有HCl、NaOH的物质的量为:3mol/L×0.1L=0.3mol,
铝与盐酸发生反应为:2Al+6HCl═2AlCl3+3H2↑,则0.3molHCl完全反应生成氢气的物质的量为:n(H2)=$\frac{1}{2}$n(HCl)=0.15mol;
Al与氢氧化钠溶液的反应为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,则0.3mol NaOH完全反应生成氢气的物质的量为:n(H2)=n(NaOH)=0.3mol,
根据V=nVm可知,相同条件下生成氢气体积与氢气物质的量成正比,则生成氢气体积之比=0.15mol:0.3mol=1:2,
故选C.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握物质的量与气体摩尔体积、物质的量浓度之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
19.分类是学习化学常用的方法,下列关于物质的分类说法正确的是( )
| A. | CO2、SO2、CO都是酸性氧化物 | B. | Na2O、Al2O3、CuO都是碱性氧化物 | ||
| C. | HCl、HClO、HClO4都是强酸 | D. | CH3COOH、HNO3、HSCN都是一元酸 |
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1L0.1mol•L-1的NaHSO4溶液中HSO4-总数为0.1NA | |
| B. | 16g16O2和18g18O2中含有的质子数均为8NA | |
| C. | 1molFe与足量的稀硝酸反应,转移电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水所得溶液中含有的氯离子数为0.1NA |
18.80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20~40s 内用N2O4表示的平均反应速率为0.002 mol•L-1•s-1.
(2)计算在80℃时该反应的平衡常数K=1.8.
(3)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4 起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度.
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K=1.8.
(3)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4 起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度.
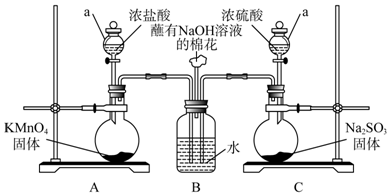
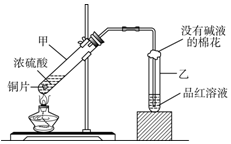 用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.
用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.
 (1)已知在一定温度下,各反应的平衡常数如下:
(1)已知在一定温度下,各反应的平衡常数如下: