题目内容
12.氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )| A. | 该反应中NH3被还原 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 若管道漏气遇氨就会产生白烟 | D. | 生成1mol N2有6mol电子转移 |
分析 反应3Cl2+2NH3=N2+6HCl中,Cl元素化合价降低,被还原,Cl2为氧化剂,N元素化合价升高,被氧化,NH3为还原剂,NH3可与HCl反应生成氯化铵,有白烟生成,以此解答.
解答 解:A.N元素化合价由-3价升高到0价,被氧化,故A错误;
B.Cl元素化合价降低,被还原,Cl2为氧化剂,故B正确;
C.反应生成HCl,NH3可与HCl反应生成氯化铵,有白烟生成,故C正确;
D.N元素化合价由-3价升高到0价,则生成1molN2时有6mol电子转移,故D正确.
故选A.
点评 本题考查氯气的性质,侧重于化学与生活、生产的联系以及氧化还原反应的考查,注意从元素化合价的角度解答该题,难度不大.

练习册系列答案
相关题目
2.20℃、1大气压下,lgH2完全燃烧生成稳定的氧化物,测得放出142.9kJ的热量.下列表示该反应的热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)═2H2O(1)△H=-149.2 kJ/mol | B. | H2(g)+O2(g)═H2O(1)△H=+285.8 kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | D. | 2H2(g)+O2(g)═2H2O(1)△H=-571.6kJ/mol |
3.下列化学用语错误的是( )
| A. | 氨分子的结构式: | B. | 氮气的结构式: | ||
| C. | 氯离子的结构示意图: | D. | 氨分子的比例模型: |
7.下列有关胶体的说法不正确的是( )
| A. | 分散系中分散质粒子的大小:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | FeCl3溶液和Fe(OH)3胶体都能透过滤纸 | |
| C. | 当一束强可见光通过Fe(OH)3胶体时会出现光亮的“通路” | |
| D. | 将饱和FeCl3溶液滴入NaOH溶液中可制得Fe(OH)3胶体 |
8.把蘸有浓盐酸的玻璃棒靠近装有氨水的试剂瓶口,为了使现象明显,可先往瓶中加入一种物质,该物质可以选用下列物质中的( )
①浓硫酸 ②固体烧碱 ③固体碳酸钙 ④生石灰 ⑤固体NH4Cl ⑥固体食盐.
①浓硫酸 ②固体烧碱 ③固体碳酸钙 ④生石灰 ⑤固体NH4Cl ⑥固体食盐.
| A. | ①② | B. | ②③④ | C. | ②④⑤ | D. | ①③⑥ |
6.当反应条件(如温度、浓度或物质的量等)发生改变时,下列不会引起生成物发生改变的是( )
| A. | 钠和氧气 | B. | 锌和硫酸 | ||
| C. | 氢氧化钠和二氧化碳 | D. | 氢气和氯气 |
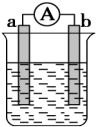 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: