题目内容
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4已知4Fe2++O2+4H+?4Fe3++2H2O
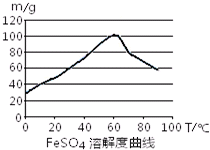
FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.此处:硫酸浓度应选择
| n(Fe) |
| n(H2SO4) |
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是
考点:硫酸亚铁的制备
专题:几种重要的金属及其化合物
分析:(1)由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法;
(2)在室温下,Fe在浓硫酸中会发生钝化现象,在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水;由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右;
为防止硫酸亚铁晶体析出,加热的同时需适当补充水,为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些;
(3)稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯.
(2)在室温下,Fe在浓硫酸中会发生钝化现象,在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水;由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右;
为防止硫酸亚铁晶体析出,加热的同时需适当补充水,为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些;
(3)稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯.
解答:
解:(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法,故答案为:倾析;
(2)在室温下,Fe在浓硫酸中会发生钝化现象.在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水,不能得到硫酸亚铁,所以要用3moL/L硫酸.由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右.为防止硫酸亚铁晶体析出,加热的同时需适当补充水.为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些.所以反应中应保持n(Fe)/n(H2SO4)>1.
故答案为:c;60℃左右;防止硫酸亚铁晶体析出;>;
(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯,
故答案为:抑制Fe2+、NH4+的水解.
(2)在室温下,Fe在浓硫酸中会发生钝化现象.在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水,不能得到硫酸亚铁,所以要用3moL/L硫酸.由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右.为防止硫酸亚铁晶体析出,加热的同时需适当补充水.为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些.所以反应中应保持n(Fe)/n(H2SO4)>1.
故答案为:c;60℃左右;防止硫酸亚铁晶体析出;>;
(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯,
故答案为:抑制Fe2+、NH4+的水解.
点评:本题考查铁盐、亚铁盐的实验方案的设计、评价、反应原理、盐类的水解等知识,题目综合性强,为高考高频考点,特别注意学习化工生产中涉及用于混合物分离和提纯的方法.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目
 新华网2005年4月2日讯:美国研究人员在网络版《科学》杂志上发表论文说,他们开发出了一种新的固体氧化物燃料电池,在用碳氢化合物--异辛烷做燃料时,能源转换效率有望达到50%.采用异辛烷(iso-C8H18)的新型固体氧化物燃料电池,相当于把氧的提纯工厂“压缩”在一个小型装置中,而且异辛烷属于直链烃类,与汽油非常类似,不需要新建基础设施,因此这种燃料电池的前景非常可观.已知该电池的原理结构如图所示,中间阴影部分为固体氧化物陶瓷,可传递氧离子,下列有关说法错误的是( )
新华网2005年4月2日讯:美国研究人员在网络版《科学》杂志上发表论文说,他们开发出了一种新的固体氧化物燃料电池,在用碳氢化合物--异辛烷做燃料时,能源转换效率有望达到50%.采用异辛烷(iso-C8H18)的新型固体氧化物燃料电池,相当于把氧的提纯工厂“压缩”在一个小型装置中,而且异辛烷属于直链烃类,与汽油非常类似,不需要新建基础设施,因此这种燃料电池的前景非常可观.已知该电池的原理结构如图所示,中间阴影部分为固体氧化物陶瓷,可传递氧离子,下列有关说法错误的是( )| A、异辛烷和氧气不需要储存在电池内,可减小电池的体积 |
| B、氢燃料电池的优点是实现零排放,缺点是氢难以制得,同时氢的提纯和储存也较为困难 |
| C、原电池负极的电极反应式为2C8H18+50O2--100e-═16CO2+18H2O |
| D、通异辛烷的电极为电池的正极 |
下列物质中既有离子键,又有共价键的是( )
| A、H2O |
| B、CaCl2 |
| C、NH4NO3 |
| D、Cl2 |
现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A、V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 |
| B、将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C、分别加水稀释10倍、四种溶液的pH:①>②>③>④ |
| D、在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
1下列有关摩尔质量的描述或应用中,正确的是( )
| A、1 mol OH-的质量为17 g?mol-1 | ||
| B、二氧化碳的摩尔质量为44 g | ||
| C、铁原子的摩尔质量等于它的相对原子质量 | ||
D、一个钠原子的质量等于
|

