题目内容
6.24mL 0.05mol/L的Na2RO3溶液恰好与20mL 0.02mol/L的K2Cr2O7溶液完全反应.已知Na2RO3被K2Cr2O7氧化Na2RO4,则Cr在还原产物中的化合价为( )| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
分析 Na2RO3被K2Cr2O7氧化Na2RO4,则R元素的化合价由+4价升高为+6价,可知Cr元素的化合价降低,结合电子守恒计算.
解答 解:设Cr在还原产物中的化合价为x,
由电子守恒可知,
0.024L×0.05mol/L×(6-4)=0.02L×0.02mol/L×2×(6-x),
解得x=+3,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握元素的化合价变化及电子守恒为解本题关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,64g SO2气体中所含分子数为NA | |
| B. | 标准状况下,4.48L四氯化碳中所含原子总数为NA | |
| C. | 1mol HNO3作氧化剂时转移电子数为3NA | |
| D. | 常温常压下,11.2L NO2中所含分子数为0.5NA |
9.在水溶液中能大量共存的一组离子是( )
| A. | NH4+、K+、Br-、Cl- | B. | Na+、Cu2+、OH-、SO42- | ||
| C. | Mg2+、H+、CH3COO-、SO42- | D. | HCO3-、NO3-、OH-、Na+ |
1.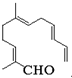 从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )
从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )
 从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )
从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )| A. | 可发生1,4-加成 | |
| B. | 与新制的Cu(OH)2悬浊液反应后得到饱和羧酸 | |
| C. | 1mol该有机物最多与含5molBr2的溴水发生加成 | |
| D. | 与H2反应时一定可得到饱和一元醇 |
15.已知一些燃料的燃烧热数据如表:
使用上述燃料,最能体现“低碳经济”理念的是( )
| 燃料 | 甲醇 | 丙烷 | 乙烷 | 乙烯 |
| △H/kJ•mol-1 | -726.0 | -2220.0 | -1560.0 | -1410.0 |
| A. | 甲醇 | B. | 丙烷 | C. | 乙烷 | D. | 乙烯 |





 ④过氧化氢的结构式:H-O-O-H
④过氧化氢的结构式:H-O-O-H