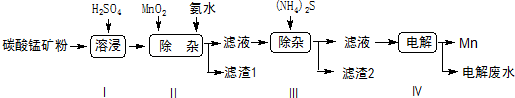
题目内容
设NA为阿伏加德罗常数的值,下列判断正确的是( )
| A、2gH2中含氢原子数为 NA |
| B、1L 1mol/L BaCl2溶液中含有的氯离子数为NA |
| C、标准状况下,22.4L H2O所含的原子数为3 NA |
| D、0.1mol铁粉在足量氯气中充分燃烧,转移的电子数为0.3NA |
考点:阿伏加德罗常数
专题:
分析:A.2gH2的物质的量是1mol;
B.1molBaCl2电离生成2mol氯离子;
C.标准状况下水不是气体;
D.铁粉在足量氯气中充分燃烧生成氯化铁.
B.1molBaCl2电离生成2mol氯离子;
C.标准状况下水不是气体;
D.铁粉在足量氯气中充分燃烧生成氯化铁.
解答:
解:A.2gH2的物质的量是1mol,含氢原子数为2NA,故A错误;
B.1molBaCl2电离生成2mol氯离子,含有的氯离子数为2NA,故B错误;
C.标况下水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故C错误;
D.0.1mol铁粉在足量氯气中充分燃烧生成氯化铁,转移的电子数为0.3NA,故D正确.
故选D.
B.1molBaCl2电离生成2mol氯离子,含有的氯离子数为2NA,故B错误;
C.标况下水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故C错误;
D.0.1mol铁粉在足量氯气中充分燃烧生成氯化铁,转移的电子数为0.3NA,故D正确.
故选D.
点评:本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
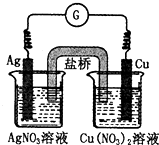 如图所示原电池的总反应为Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s),下列叙述正确的是( )| A、电子从银电极经导线流向铜电极 |
| B、工作一段时间后,右烧杯中溶液的pH变小 |
| C、电池工作时,Cu2+向铜电极移动 |
| D、将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针反向偏转 |
设NA为阿伏加德罗常数的值,则下列说法正确的是( )
| A、1mol苯酚中“C=C”的个数为3NA | ||
| B、2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | ||
C、标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为
| ||
| D、常温常压下,22.4L丙烷所含有的共价键数目为10NA |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示,下列叙述中正确的是( )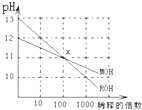

| A、MOH和ROH都是强碱 |
| B、在x点,c(M+)=c(R+) |
| C、稀释前,c(ROH)=10c(MOH) |
| D、常温下,pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈酸性 |
下列物质中,属于电解质的是( )
| A、蔗糖 | B、盐酸 |
| C、氯化钠 | D、二氧化碳 |
下列说法正确的是( )
| A、二氧化碳分子中存在共价键和分子间作用力 |
| B、甲烷、氨和水都是由极性键结合而成的极性分子 |
| C、同主族不同元素的最高价氧化物,一定具有相同的晶体结构 |
| D、氟化氢的沸点高于氯化氢的沸点,正丁烷的沸点高于异丁烷的沸点 |